[物质结构与性质,13分]
(1)与铜同周期、基态原子最外层电子数相同的过渡元素,其基态原子的电子排布式 。
(2)下图曲线表示部分短周期元素的原子序数(按递增顺序排列)和其常见单质沸点的关系。其中A点表示的单质是 (填化学式)。
| 键长/(pm) |
B—F |
B—Cl |
B—Br |
| 计算值 |
152 |
187 |
199 |
| 实测值 |
130 |
175 |
187 |
(3)三氟化硼分子的空间构型是 ;三溴化硼、三氯化硼分子结构与三氟化硼相似,如果把B-X键都当作单键考虑来计算键长,理论值与实测键长结果如右表。硼卤键长实测值比计算值要短得多,可能的原因是 。
(4)海产品添加剂多聚磷酸钠是由Na+与多聚磷酸根离子组成的,某种多聚磷酸根的结构如图。
①磷原子的杂化类型为 。
②这种多聚磷酸钠的化学式为 。
(5)已知HF与F-通过氢键结合成HF 。判断HF
。判断HF 和HF
和HF 微粒间能否形成氢键,并说明理由。
微粒间能否形成氢键,并说明理由。
。
(8分)以下6种物质中选取序号填空(可重复选填)。
①二氧化碳 ②硫化氢 ③氯化铵 ④氢氧化钾 ⑤甲醛 ⑥乙醇
(1)含有非极性键的是________;(2)含有配位键的是________;
(3)既含有σ键又含有π键的是________;(4)属于非极性分子的是________;
(5)分子的立体结构呈平面三角形的是________;(6)属于离子晶体的是________。
某实验小组用下列装置进行乙醇催化氧化的实验。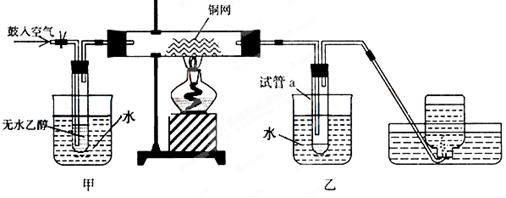
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
、.
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是加热;乙的作用是。
(3)反应进行一段时间后,试管a中能收集到不同的物质,它们是。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有另一种杂质,
要除去该杂质,可在混合液中加入(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过 (填试验操作名称)即可除去。
(10分)下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。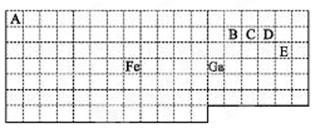
根据信息回答下列问题。
(1)周期表中基态Ga原子的最外层电子排布式为 。
(2)Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为 ;
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 。
(4)根据VSEPR理论预测ED4—离子的空间构型为 。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的分子的电子式为 (写2种)。
实验室制配0.40mol/L的NaCl溶液80mL,有以下仪器:烧杯 、100 mL量筒、100 mL容量瓶 、50 mL容量瓶 、玻璃棒 、托盘天平(带砝码)、药匙、胶头滴管
(1)配制该溶液应选用___________mL容量瓶;
(2)向容量瓶中加入蒸馏水,到液面________________________时,改用___________加蒸馏水至液面最低点与刻度线相切,最后________(填所选字母:A.左右旋转 B.上下颠倒)摇匀。
(3)取80ml配制好的溶液,加水稀释到200ml,这浓度变为。
(4)配制一定物质的量浓度的溶液,造成浓度偏高的操作是
A.定容摇匀后发现液面低于刻度线
B.定容时俯视容量瓶的刻度线
C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作
D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线
(1)NaCl的摩尔质量是; 0.1molCO2的质量是 ,它在标准状况下的体积约为;在0.5L 0.2 mol·L-1的 Ba(NO3)2溶液中NO3-的物质的量浓度为。
(2)等质量的SO2和SO3分子数之比为________,同温同压下的密度之比为_________,含氧原子数之比为___________,体积之比为___________.