卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁。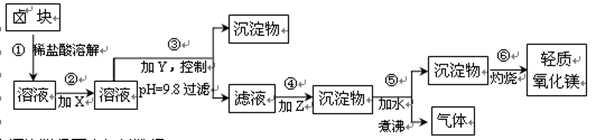
查阅资料得下表相关数据:
| 表1: 生成氢氧化物沉淀的pH |
表2: 原料价格表 |
|||
| 物质 |
开始沉淀 |
沉淀完全 |
物质 |
价格(元/吨) |
| Fe(OH)3 |
2.7 |
3.7 |
a.漂液(含25.2%NaClO) |
450 |
| Fe(OH)2 |
7.6 |
9.6﹡ |
b.双氧水(含30%H2O2) |
2400 |
| Mn(OH)2 |
8.3 |
9.8 |
c.烧碱(含98%NaOH) |
2100 |
| Mg(OH)2 |
9.6 |
11.1 |
d.纯碱(含99.5%Na2CO3) |
600 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽。
若要求产品尽量不含杂质且生产成本较低,请根据上表提供的资料回答:
(1)流程中加入的试剂X、Y、Z最佳选择依次是表2中的 (选填试剂编号)。
(2)步骤②发生反应的离子方程式为 ;步骤⑤中发生反应的化学方程为 。
(3)步骤③控制pH=9.8的目的是 。
(4) 若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、 和
泥三角。
(5)在探究Mg(OH)2溶解性的实验中,发现向装有少量Mg(OH)2浊液的试管中加入适量
NH4Cl晶体,充分振荡后溶液会变澄清,请用化学平衡的原理解释浊液变澄清的原
因 。
化合物F是合成某种抗癌药物的中间体,其合成路线如下: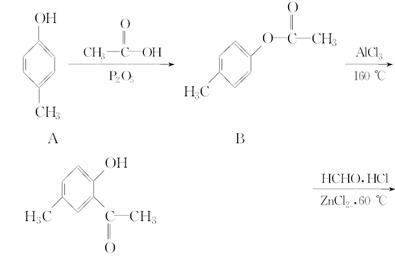
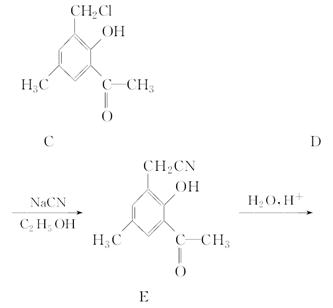
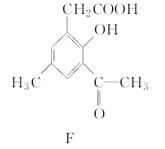
(1)化合物F中的含氧官能团有羰基、________和________(填官能团名称)。
(2)由化合物D生成化合物E的反应类型是_____________________________。
(3)由化合物A生成化合物B的化学方程式是_________________________________________________________。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式:____________________________。
①分子中有4种不同化学环境的氢原子;②能发生银镜反应,且其一种水解产物也能发生银镜反应;③分子中苯环与氯原子不直接相连。
(5)苯乙酸乙酯(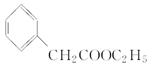 )是一种重要的化工原料。请写出以苯、甲醛和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
)是一种重要的化工原料。请写出以苯、甲醛和乙醇为主要原料制备苯乙酸乙酯的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
H2C===CH2 CH3CH2Br
CH3CH2Br CH3CH2OH
CH3CH2OH
喹硫平可用于精神疾病的治疗,它的合成路线如下: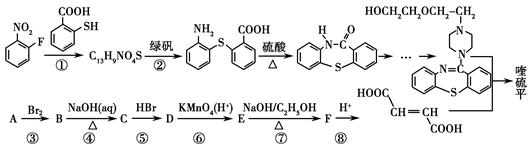
(1)写出C13H9NO4S中所有含氧官能团的名称:________。
(2)A属于烃,且相对分子质量是54,写出A的结构简式:____________。
(3)反应①~⑤中属于取代反应的有________(填序号)。
写出反应⑦的化学方程式:__________________________________________。
(4)流程中设计反应⑤和⑦的目的是___________________________________。
(5)物质C的同分异构体有多种,其中既含有羟基,又含有醛基的同分异构体有________种。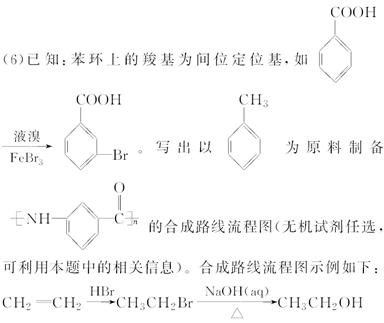
莫沙朵林是一种镇痛药,它的合成路线如下: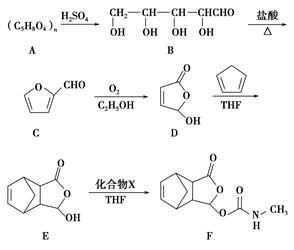
(1)B中手性碳原子数为________;化合物D中含氧官能团的名称为________。
(2)C与新制氢氧化铜反应的化学方程式为_______________________。
(3)写出同时满足下列条件的E的一种同分异构体的结构简式:_________________________________________________。
①核磁共振氢谱有4个峰;
②能发生银镜反应和水解反应;
③能与FeCl3溶液发生显色反应。
(4)已知E+X―→F为加成反应,化合物X的结构简式为____________。
(5)已知: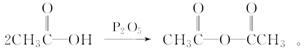 化合物
化合物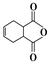 是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以
是合成抗病毒药阿昔洛韦的中间体,请设计合理方案以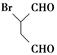 和
和 为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
为原料合成该化合物(用合成路线流程图表示,并注明反应条件)。合成路线流程图示例如下:
CH3CH2OH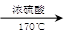 CH2===CH2
CH2===CH2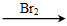
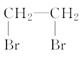
化合物F(匹伐他汀)用于高胆固醇血症的治疗,其合成路线如下: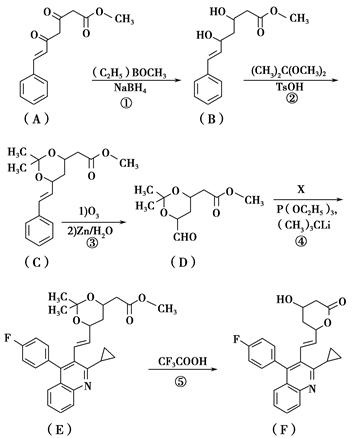
(1)化合物D中官能团的名称为________、________和酯键。
(2)A→B的反应类型是____________。
(3)写出同时满足下列条件的A的一种同分异构体的结构简式:________________。
①分子中含有两个苯环;②分子中有3种不同化学环境的氢;③不含—O—O—。
(4)实现D→E的转化中,化合物X的分子式为C19H15NFBr,写出其结构简式:________________。
(5)已知:化合物E在CF3COOH催化作用下先转化为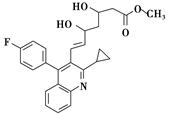 ,再转化为F。你认为合成路线中设计步骤②的目的是___________________________________________________。
,再转化为F。你认为合成路线中设计步骤②的目的是___________________________________________________。
(6)上述合成路线中,步骤③的产物除D外还生成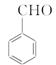 ,该反应原理在有机合成中具有广泛应用。试写出以
,该反应原理在有机合成中具有广泛应用。试写出以 为主要原料制备
为主要原料制备 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下: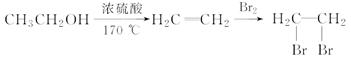
Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。
钴的有关性质如下:Co(OH)2具有两性。钴的主要物理、化学参数与铁、镍接近,属铁族元素。
结合以上信息试回答下列问题:
(1)Co(OH)2的制备是在CoCl2溶液中加稍过量的氨水,不用NaOH溶液的原因是________________________________(用化学方程式表示)。制得的Co(OH)2不宜在空气中长期放置,会被空气中的O2氧化,化学方程式为_____________________________________________________。
(2)如图,已知钴的氢氧化物加热至290 ℃时已完全脱水,则1000 ℃时,剩余固体的成分为________________________(填化学式);在290~500 ℃范围内,发生的反应的化学方程式为__________________________________________。
(3)已知常温下,在0.10 mol·L-1 CoCl2溶液中加入氨水充分搅拌,有Co(OH)2沉淀生成,当溶液的pH=8时,c(Co2+)=________mol·L-1(Ksp[Co(OH)2]=1.6×10-15)。常温下反应Co2++2H2OCo(OH)2+2H+的平衡常数为
_______________________________。