《物质结构与性质》
A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
⑴判断离子AB2-离子的空间构型为 。
⑵元素A、C形成的化合物熔点很高,但比B、C形成的化合物熔点低,其原因是 。
⑶在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是 。
⑷元素B与D形成的一种化合物广泛应用于录音磁带上,其晶胞如图所示。该化合物的化学式为 。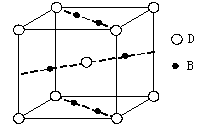
⑸向D的氯化物DCl3溶液中滴加氨水可形成配合物[D(NH3)3(H2O)Cl2]Cl。
①离子D3+的外围电子排布式为 。
②1 mol该配合物中含配位键的数目为 。
工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下: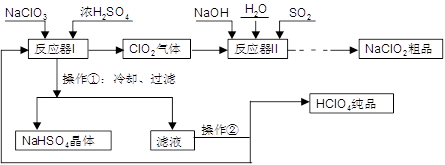
(1)实验室进行过滤操作的常用玻璃仪器有。
(2)反应器I中的温度最佳为(填序号);操作②的名称为。
A. 0°C ; B. 20°C ; C. 80°C ; D. 120°C
(3)反应器II中发生反应的离子方程式为。
(4)加快反应器II中反应速率的措施有(写出一种措施即可)等。从反应器II中获得NaClO2粗品的实验操作依次是(填序号,下同),进一步提纯的操作名称为。
A.过滤 B.重结晶 C.蒸馏 D.蒸发浓缩 E.蒸干灼烧 F.冷却结晶 G.萃取分液
(5)上述流程中可循环使用的物质为,副产品除NaClO2、NaHSO4外还有(填化学式)。
(1)已知: C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g)ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g) +O2(g)= H2O(g)+CO2(g),ΔH= _______kJ/mol。
(2)在一恒容的密闭容器中,由CO和H2合成甲醇:CO(g)+2H2(g) CH3OH(g)ΔH
CH3OH(g)ΔH
①下列情形不能说明该反应已达到平衡状态的是_______(填序号)。
A.每消耗1 mol CO的同时生成2molH2
B.混合气体总物质的量不变
C.生成CH3OH的速率与消耗CO的速率相等
D.CH3OH、CO、H2的浓度都不再发生变化
②CO的平衡转化率(α)与温度、压强的关系如图所示。A、B两点的平衡常数K(A)_______K(B)(填“>”、“=”或“<”,下同);由图判断ΔH _____0。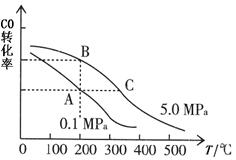
③某温度下,将2.0 mol CO和6.0 molH2充入2 L的密闭容器中,充分反应后,达到平衡时测得c(CO)="0.25" mol/L,则CO的转化率=,此温度下的平衡常数K=(保留二位有效数字)。
(3)工作温度650℃的熔融盐燃料电池,用煤炭气(CO、H2)作负极反应物,空气与CO2的混合气体为正极反应物,催化剂镍作电极,用一定比例的Li2CO3和Na2CO3低熔点混合物作电解质。负极的电极反应式为:CO+H2-4e-+2CO32-=3CO2+H2O;则该电池的正极反应式为。
工业上用甲苯生产对羟基苯甲酸乙酯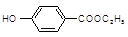 ,生产过程如下图:
,生产过程如下图: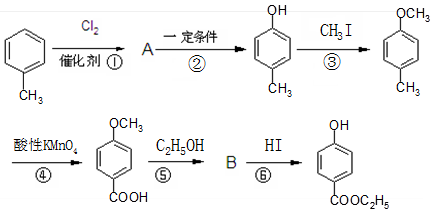
(1)对羟基苯甲酸乙酯的分子式为;1mol 该物质与NaOH溶液完全反应,最多消耗______molNaOH。
(2)化合物A中的官能团名称是_________,反应④的反应类型属________。
(3)反应①的化学方程式_______________。
(4)在合成线路中,设计第③和⑥这两步反应的目的是__________。
(5)有机物C(分子构型为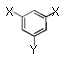 ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是、。
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是、。
某同学利用如图装置制NO并进行相关实验探究。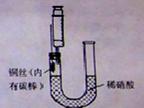
(1)写出制备NO的反应方程式
(2)收集的气体与空气混合后变红色,这说明NO具有_____性。
(3)制备NO的步骤如下:
1按图所示连接好装置;
2取下注射器,通过U型长管加入稀硝酸至接近U型短管的铜丝
3在针头上安装好注射器,抽出U型短管中的所有空气;然后拔出注射器,并排尽注射器中的空气。
4待硝酸与铜丝分离后,用已排除空气的注射器抽出生成NO,将注射器针头插入橡皮塞中以封口。
在上述操作中遗漏的一个步骤是,在步骤3中可以观察到的现象为。
(4)在铜丝上绑上石墨的作用是。
(5)若将稀硝酸换成浓硝酸,则可制取NO2气体。请你用注射器收集NO2气体并完成“外界因素对化学平衡移动影响”实验探究,相关内容填在下面表格。(只完成一个影响因素的探究,其他实验用品自选)已知
2NO2(g)  N2O4(g) △H <0;N2O4为无色气体。
N2O4(g) △H <0;N2O4为无色气体。
| 实验步骤 |
实验现象 |
实验结论 |
| ①分别用两支注射器收集NO2,并将注射器针头插入橡皮塞中以封口。 ②_____________________ _______________________ ________________________ _______________________ ________________________ |
_______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ |
_______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ |
工业上利用含有一定浓度的I2和CuSO4溶液的工业废水制备饲料添加剂Ca(IO3)2,其生产流程如下:
已知:Ca(IO3)2微溶于水,溶于硝酸;Ksp(CuI)=1.1×10-12, Ksp(Cu2S)=2.5×10-48;
氧化性: HNO3>IO3—>H2O2
(1)“还原”过程中主要反应的化学方程式为:2Na2S2O3+I2 =+ 2NaI。
(2)在还原过程还伴随有CuI生成,写出加入Na2S的离子反应方程式。
(3)在氧化过程中先加入H2O2再加入浓硝酸,而不直接加入浓硝酸的目的是。
(4)加入的石灰乳在溶液中反应而得到Ca(IO3)2,则要调节pH至(填“酸性” 或“中性”或“碱性”),原因是。
(5)Ca(IO3)2也可用电化学氧化法制取:先充分电解KI溶液,然后在电解后的溶液中加入CaCl2,最后过滤得到Ca(IO3)2。写出电解时阳极发生的电极反应方程式 ,用该方法制取Ca(IO3)2,每1kg碘化钾理论上可生产纯度为97.8%Ca(IO3)2的质量为____kg(计算结果保留3位有效数字)。