(15分)碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g)  Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是
(填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
B.缩小容器容积,平衡右移, H减小 H减小 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 |
| D.当4vNi(CO)4=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+ O2(g)==CO(g)
O2(g)==CO(g)  H= -Q1 kJ·mol-1
H= -Q1 kJ·mol-1
C(s)+ O2(g)==CO2(g)  H= -Q2 kJ·mol-1
H= -Q2 kJ·mol-1
S(s)+O2(g)==SO2(g)  H= -Q3 KJ·mol-1
H= -Q3 KJ·mol-1
则SO2(g)+2CO(g)==S(s)+2CO2(g)  H= kJ·mol-1。
H= kJ·mol-1。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图(1)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时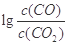 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图(2)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
一个课外兴趣小组对某只含Cu、Fe的合金成分含量进行分析(装置见图)。
方法:按图示取a g的Cu、Fe合金和纯铜做为电极,电解液里是含足量的Cu2+离子。接通电源进行实验,一直通电到Cu、Fe合金刚好全部溶解时为止。实验结果是:发现在通电实验过程中两电极均无气体产生,纯铜电极上质量增加19.2g,电解液的质量减少0.8g。请回答:
(1)写出电极反应:阳极;
阴极。
(1)该合金中Cu和Fe的物质的量之比是_________________________。
(3)若另取该合金a g把该Cu、Fe合金与足量的稀硝酸反应后,在溶液中再加入NaOH,能得到的最大沉淀量是________ _g。
银锌电池广泛用作各种电子仪器的电源,其电极分别是Ag2O和锌,电解液为KOH溶液。电池反应是:Ag2O+Zn+H2O="2Ag" +Zn(OH)2,根据上述判断:
(1)原电池的正极是__________,负极是__________。
(2)原电池电极反应式为:负极_______________,正极______________。
(3)工作时原电池负极附近溶液的pH__________ (填“增大”、“不变”、“减小”)。
由氢气和氧气反应生成1mol水蒸气放热241.8KJ。
(1)写出该反应的热化学方程式_______________________。
(2)若1g水蒸气转化成液态水时放热2.444KJ,则反应H2(g) + 1/2O2(g) ==H2O(l)的
△H=______________kJ· 。
。
以下是依据一定的分类标准,对某些物质与水反应的情况进行分类的分类图。请根据你所学的知识,按要求填空:
(1)上述物质的分类方法是;
(2)根据物质与水反应的情况,分成A、B组的分类依据是(选择字母填空,下同),由A组分成C、D组的依据是(填字母)。
a.与水反应后溶液的酸碱性 b.与水反应的剧烈程度 c.是否发生氧化还原反应
(3)F组的物质是(填化学式)。
(4)A组中的酸性氧化物与B组中的某物质反应可用作呼吸面具或潜水艇中氧气的来源,其反应方程式为。
分析下列反应:5KCl + KClO3 + 3H2SO4 = 3Cl2↑+ 3K2SO4 + 3H2O,据此作答:
(1)标出该反应中电子的转移方向和数目:
5KCl + KClO3 + 3H2SO4 = 3Cl2↑+ 3K2SO4 + 3H2O
(2)该反应的氧化剂是。
(3)该反应的氧化产物与还原产物的质量比是。
(4)当反应生成0.3 mol Cl2时,则转移的电子的物质的量是。