(9分)元素周期律是指导我们学习元素及其化合物知识的重要工具。已知氧族元素(不含Po)的部分知识如下表所示,
| 元素 |
8O |
16S |
34Se |
52Te |
| 单质熔点(℃) |
-218.4 |
113 |
|
450 |
| 单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
| 元素主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
| 原子半径 |
逐渐增大 |
|||
| 单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
请总结表中知识规律,并依据元素周期律回答下列问题:
(1)单质硒的熔点范围可能是________________。
(2)元素碲的主要化合价可能有________________。
(3)硫、硒、碲的氢化物水溶液的酸性由强至弱的顺序是________________(用化学式表示)。
(4)氢硒酸有较强的__________(填“氧化性”或“还原性”),因此露置在空气中长期保存易变质,其可能发生反应的化学方程式为_________________________________。
(5)下图所示为氧族元素单质与H2反应过程中的能量变化示意图,其中a、b、c、d分别表示氧族元素中某一元素的单质,纵坐标为相同物质的量的单质与H2反应过程中的能量变化(能量变化>0表示放热,能量变化<0表示吸热)。则:b代表___________ _____, d代表 (均写单质名称)。
H2S是一种无色、有毒的可燃性气体,其水溶液叫氢硫酸(二元弱酸)。
(1)实验室可用硫化亚铁固体与稀硫酸反应来制备H2S气体。
①该反应的化学方程式为。
②多余的H2S气体可用溶液来吸收,不能用燃烧的方法处理H2S气体的理由是。
(2)用30% FeCl3溶液作吸收液也能吸收H2S气体,反应方程式为:2FeCl3+H2S = S↓+2FeCl2+2HCl,废吸收液经电解可循环使用。
①该反应中H2S显(填字母)。
a、不稳定性b、弱酸性c、氧化性d、还原性
②检验废吸收液中是否含有Fe3+的适宜试剂是。
③强酸性的废吸收液电解可生成FeCl3和一种分子量最小的气体,则化学方程式为。
(3)已知:H2S在高温下分解生成硫蒸气和H2。现测得某温度下,H2S分解过程中各物质的物质的量随时间变化关系如图所示。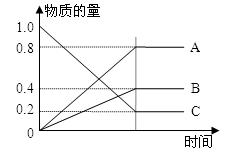
①表示H2的曲线是(填“A”、“B”或“C”)。
②生成硫蒸气的分子式为。
高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制250.00 mL 0.1000 mol•L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、。
②配制过程中玻璃棒所起的作用是。
③下列操作对实验结果的影响偏小的是(填序号)。
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.颠倒摇匀后发现凹液面低于刻度线又加水补上
(2)用上述酸性KMnO4溶液来测定FeSO4溶液中Fe2+的物质的量浓度。
①配平该反应的化学方程式:FeSO4 + KMnO4 + H2SO4  K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
②实验时应测定的数据有:量取FeSO4溶液的体积和。
化学与人类生活密切相关。请按要求,回答下列问题:
(1)漂白粉有效成分的化学式为,其能消毒杀菌是因有强性。
(2)KAl(SO4)2•12H2O的俗名为,因其溶于水生成而具有净水作用。
(3)酸雨的pH小于,含亚硫酸的酸雨久置后pH(增大、减小或不变)。
(4)小苏打可用于治疗胃酸过多,其反应的离子方程式为。
(15分)本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题,每位考生只可选做一题。若两题都作答,则以A题计分。
A.《化学与生活》
(1)良好的生态环境可以提升生活质量。
①空气质量报告的各项指标可以反映出各地的空气质量。下列各项中目前未列入我国空气质量报告的是(选填字母,下同)。
a.SO2
b.NO2
c.CO2
d.PM2.5
e.氯氟烃
②垃圾应分类收集。以下物质应放置于贴有“ ”标志垃圾筒的是。
”标志垃圾筒的是。
a.废电池b.废铝制的易拉罐c.建筑固弃物、渣土
③近日,公安机关成功破获了一起特大利用“地沟油”制售食用油案件。综合利用“地沟油”的一种方法,通常将“地沟油”进行简单加工提纯后,水解分离可获取和(填名称)。
(2)人体健康与食品、药物等关系密切。
①合理搭配饮食是我们的健康理念。比如早餐搭配:牛奶、面包、黄油、水果等,其中含有的营养素有油脂、糖类、、、无机盐和水。
②生活中应合理地摄取人体必需的元素,体内元素含量过高或过低,会引起甲状腺疾病;当人体内缺钙时,可能患有的疾病是。
a.贫血b.骨质疏松 c.夜盲症
③氢氧化铝可以用来治疗胃酸过多,请写出该反应的离子方程式。
④青霉素适合治疗的疾病是。
a.感冒发烧b.细菌感染c.胃酸过多
(3)材料是人类赖以生存和发展的重要物质基础。
①在下列材料中,属于有机高分子材料的是;属于复合材料的是。
a.硬币b.聚氯乙烯塑料 c.氮化硅陶瓷 d.玻璃钢
②硅酸盐水泥是常用的建筑材料,它主要是以和黏土为原料制成。
③钢铁在潮湿的空气中主要发生的电化学腐蚀是腐蚀,通常用钝化、涂漆、电镀等方法来防止腐蚀。
B.《有机化学基础》
(1)有机化合物的制备、提纯和检验是有机化学研究的基础。
①实验室用乙醇和浓硫酸反应制备乙烯,应将反应温度控制在(填字母。下同)左右。
a.140℃b.170℃c.100℃
②蛋白质提纯可用盐析法,下列盐溶液能用于蛋白质提纯的有。
a.Na2SO4 b.AgNO3c.CuCl2
③鉴别乙酸和甲酸甲酯,可采用的方法是。
a.取样,滴加银氨溶液,水浴加热,观察是否有银镜生成
b.取样,加入乙醇,观察液体是否分层
c.取样,测定试样的核磁共振氢谱,观察谱图中吸收峰的个数
(2)某地近日自来水产生异味,原因是水源被苯酚污染。含苯酚的工业废水必须处理达标后才能排放,苯酚含量在1 g·L-1以上的工业废水应回收苯酚。某研究性学习小组设计下列流程,探究废水中苯酚的回收方法。
①可用为试剂检验水样中是否含有苯酚。
②操作I的名称为,试剂a的化学式为。
③通入CO2发生反应生成苯酚的化学方程式为。
(3)某有机物的分子式为C3H6O3。
①1mol该有机物充分燃烧生成CO2和H2O,消耗O2在标准状况下的体积为L。
②官能团决定有机物的化学性质。取等量的该有机物两份,分别与足量的碳酸氢钠和金属钠反应,生成的气体在同温同压下体积相等。该有机物含有的官能团为、(填名称),请写出该物质的一种结构简式。
③若该有机物两分子间相互反应能生成含有六元环状结构的产物,写出该产物的结构简式。
选考[选修5:有机化学基础]
充分燃烧1.4 g某有机物A生成4.4 gCO2和1.8 g H2O,该有机物蒸气的密度是相同条件下H2密度的28倍。
(1)该有机物的实验式为________,分子式为________。
(2)A的链状同分异构体共________种。
(3)A的链状同分异构体中含有支链的同分异构体的结构简式为________,其名称为________。
(4)B是A的某种同分异构体,B的磁共振氢谱中只有4个信号峰(即只有4种氢原子),B中官能团为_____(用化学式表示),B通入Br2的CCl4溶液褪色,生成化合物C。则由B生成C的化学方程式为________。