乙醇汽油作为一种新型清洁燃料,是目前世界上可再生能源的发展重点,而且具有较好的经济效益和社会效益,终将成为汽油和柴油的替代品。
(1)写出乙醇完全燃烧的化学方程式:______________________________。
(2)乙醇燃烧时如果氧气不足,可能还有CO生成。用如图装置验证乙醇的燃烧产物中有CO、CO2、H2O,应将乙醇的燃烧产物依次通过(按气流从左到右的顺序填装置编号)________。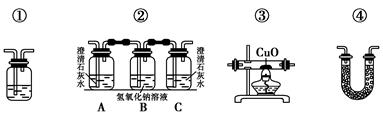
(3)实验时可观察到装置②中A瓶的石灰水变浑浊。A瓶溶液的作用是________________;B瓶溶液的作用是________________;C瓶溶液的作用是_________________________。
(4)装置③的作用是________________;装置①中所盛放的是________________,作用是_______________________________________。
(5)装置④中所盛的固体药品是______________,它可以验证的产物是_____________。
(6)尾气应如何处理?___________________。
(7)海底有大量的甲烷水合物。等质量的甲烷和乙醇完全燃烧产生温室气体CO2较多的是________。
科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-―→2O2-)。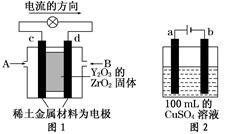
(1)c电极的名称为,d电极上的电极反应式为。
(2)如图2所示用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为,若a电极产生56 mL(标准状况)气体,则所得溶液的pH=(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入(填序号)。
a.CuOb.Cu(OH)2
c.CuCO3d.Cu2(OH)2CO3
在一个U形管里盛有CuCl2溶液,并插入两块锌片作电极,按如图连接。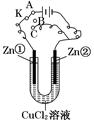
(1)如果把电键K接A,该装置应是电解装置,Zn①极是极,电极反应式为,Zn②极是极,电极反应式为。
(2)上述反应进行5 min后,转换电键K到C,则这个装置是原电池装置,Zn①极是极,电极反应式为。
(3)上述装置进行2 min后,再转换电键K到B,则Zn①极发生的化学反应为,Zn②极发生的有关电化学的反应为。
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验 编号 |
HA的物质的量浓度(mol·L-1) |
NaOH的物质的量浓度(mol·L-1) |
混合后溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还弱酸?
。
(2)乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是。
A.前者大B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=mol/L。
(Ⅱ)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B=H++HB-;HB- H++B2-
H++B2-
回答下列问题:
(5)在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
环境中常见的重金属污染物有:汞、铅、锰、铬、镉。处理工业废水中含有的Cr2O72-和CrO42-,常用的方法为还原沉淀法,该法的工艺流程为CrO42-H+①转化Cr2O72-Fe2+②还原Cr3+OH-③沉淀Cr(OH)3↓。
其中第①步存在平衡2CrO42- (黄色)+2H+ Cr2O72- (橙色)+H2O。
Cr2O72- (橙色)+H2O。
(1)写出第①步反应的平衡常数表达式。
(2)关于第①步反应,下列说法正确的是。
A.通过测定溶液的pH可以判断反应是否已达到平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol Cr2O72-,需要mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为。
(5)在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)  Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol/L,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):。
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子浓度由大到小的顺序为。
(2)B为0.1 mol·L-1 NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入,目的是;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为。