(1)一定条件下某烃与H2按物质的量之比1:2加成生成 ,则该烃的结构简式可能为: 、 。
,则该烃的结构简式可能为: 、 。
(2)某有机物X分子中只含C、H、O三种元素,相对分子质量小于110,其中氧元素的质量分数为14.8%,已知该物质可与FeCl3溶液发生显色反应,则X的分子式为__________。若1 mol X与浓溴水反应时消耗了3 mol Br2,则X的结构简式为 。
(3)分子式为C4H8的烃,核磁共振氢谱图中有两个吸收峰,峰面积比为3:1,请写出符合条件的所有物质的结构简式 、 。
下列括号内为杂质,将除去下列各组混合物中杂质所需的试剂和方法填写在横线上。
溴乙烷(乙醇)_______________,________________
苯酚(苯)_______________,______________________________________
写出②操作中涉及到的反应的化学方程式______________________________________、
______________________________________
(5)已知: ,如果要合成
,如果要合成 所用的原始原料可以是
所用的原始原料可以是
A.2-甲基-l,3-丁二烯和2-丁炔
B.2,3-二甲基-1,3-戊二烯和乙炔
C.2,3-二甲基-l,3-丁二烯和丙炔
D.1,3-戊二烯和2-丁炔
下图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量不减少,请回答下列问题: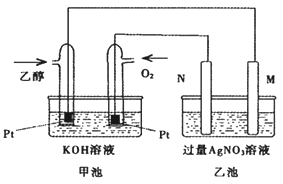
(1)M电极的组成元素在周期表中的位置是_________________,电极名称是__________,加入乙醇的铂电极的电极反应式为________________,写出乙池中发生的化学反应的离子式________________;
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为____________L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为________;
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量表示该反应的热化学方程式为________________;
(4)甲烷也是一种很好的清洁能源.蕴藏在海底的“可燃冰”是高压下形成的外观像冰的甲烷水合物固体.甲烷气体燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ/mol.356g“可燃冰”(若分子式为CH4•9H2O)释放的甲烷气体完全燃烧生成液态水.放出的热量为__________kJ;
海水中蕴藏着丰富的资源,海水综合利用的流程图如下:
(一)某化学研究小组用右图装置模拟步骤I电解食盐水(用铁和石墨做电极)。
(1)a电极材料是 (填铁、石墨),其电极反应式为 。
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为 (忽略反应前后溶液体积的变化)。
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答下列问题:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+。下表是生成氢氧化物沉淀的pH:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
Mg(OH)2 |
| 开始沉淀pH |
2.7 |
8.1 |
3.8 |
9.5 |
| 完全沉淀pH |
3.7 |
9.6 |
4.8 |
11.0 |
(3)把MgCl2粗产品的溶液中的Fe2+转化为Fe3+,可选用的物质是______________(填序号,下同),加入
调节溶液的pH,充分反应后过滤,可得MgCl2溶液。
a.KMnO4 b.H2O2 c.MgO d.NaOH
(4)步骤Ⅲ由MgCl2·H2O获得MgCl2的操作是: 。
(三)制取工业溴:
(5)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是 。
(6)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式: 。
(1)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。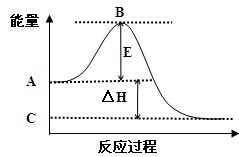 请回答下列问题:
请回答下列问题: ①图中A点表示:
①图中A点表示:
C点表示:
E的大小对该反应的反应热 (填“有”或“无”)影响。 ②图中△H= kJ/mol。
②图中△H= kJ/mol。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
(1)除去混入Fe2O3粉末中少量Al2O3杂质的试剂是 ,
离子方程式为 。
(2)除去NaCO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 。
(3)用离子方程式表示怎样用化学方法除去下列物质中混有的少量杂质:
①铁粉中混有铝粉
②FeCl2溶液中混有FeCl3
③FeCl3溶液中混有FeCl2
(4)通常用 试剂除去CO2中的HCl气体,反应的离子方程式为 。
如何除去杂质,提纯下列各物质
| 混合物成分 |
提纯所用试剂的化学式 |
| (1)MgO中混有少量Al2O3杂质 |
|
| (2)FeCl2溶液中混少量FeCl3 |
|
| (3)FeCl3溶液中混少量FeCl2 |
|
| (4)FeSO4溶液中混少量CuSO4 |
|
| (5)NaCl溶液中混有少量NaBr |