(1)2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH= —99kJ/mol。
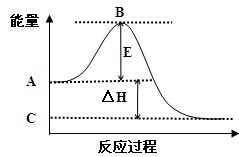 请回答下列问题:
请回答下列问题:
 ①图中A点表示:
①图中A点表示:
C点表示:
E的大小对该反应的反应热 (填“有”或“无”)影响。
 ②图中△H= kJ/mol。
②图中△H= kJ/mol。
(2)由氢气和氧气反应生成1 mol水蒸气,放出241.8 kJ热量(25℃、101 kPa下测得)
①写出该反应的热化学方程式:
②若1 mol水蒸气转化为液态水放热45kJ,则反应H2(g) +1/2O2(g) = H2O( l )的ΔH = kJ/mol。氢气的燃烧热为ΔH = kJ/mol。
A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素名称为,C的原子结构示意图为;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为,其基态原子的电子排布式为。
(4)E元素基态原子的M层全充满,N层 没有成对电子,只有一个未成对电子,E的元素符号为,其基态原子的简化电子排布式为。
没有成对电子,只有一个未成对电子,E的元素符号为,其基态原子的简化电子排布式为。
(1)砷原子的最外层电子排布式是4s24p3,在元素周期表中,砷元素位于第周期族;最高价氧化物的化学式为,砷酸钠的化学式是。
(2)已知下列元素在周期表中的位置,写出它们价电子排布式和元素 符号:
符号:
①第4周期ⅣB族 ;
;
②第5周期ⅦA族。
(8分) 将一定质量的Al、Fe混合物加入到足量的盐酸中,充分反应后得到标准状况下的氢气8.96L;如果将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标准状况下的氢气6.72L。
(1)写出与碱反应涉及的化学方程式:_____________________________________
(2)混合物中Al和Fe的质量分别为________和__________
(3)当混合物与盐酸反应时,转移电子数为_______mol;与NaOH溶液反应时转移电子
数为_______mol。
A、B、C、D四种可溶性盐,它们的阳离子分别可能是Ba2+、Ag+、Na+、Cu2+中的某一种,阴离子分别可能是NO3—、SO42—、Cl—、SO32—的某一种。
①若把四种盐分别溶解于盛有蒸馏水的四只试管中,只有C盐的溶液呈蓝色。
②若向①的四只试管中分别加盐酸,B盐溶液有沉淀产生,D盐溶液有刺激性气体逸出。根据实验事实可推断它们的化学式为:
A_________、B_________、C_________、D____________
A是用途最广的金属,B、C是两种常见气体单质,E溶液为常见强酸,D溶液中滴加KSCN溶液显红色,它们相互转化关系如图所示。
请回答:
(1)写出B物质的化学式:;F的名称:。
(2)写出第③步反应的化学方程式为。
(3)第④步反应中溶液颜色的变化;
写出第④步反应的离子方程式。
(4)写出SO2和B反应的离子方程式。
(5)F溶液中滴入NaOH溶液可能产生的实验现象是。