(8分)类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质。请结合元素周期律完成下列问题:
| 元素 |
8O |
16S |
34Se |
52Te |
| 单质熔点(℃) |
-218.4 |
113 |
|
450 |
| 单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
| 主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
| 原子半径 |
逐渐增大 |
|||
| 单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
(1)硒的熔点范围可能是 。
(2)碲的化合价可能有 。
(3)氢硒酸有较强的还原性。因此放在空气中长期保存易变质,其可能发生的化学方程式为:
。
(4)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
Al2Te3+ →Al(OH)3↓+ H2Te↑
某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
| 编号 |
电极材料 |
电解质溶液 |
电流计指针偏转方向 |
| 1 |
Mg、Al |
稀盐酸 |
偏向Al |
| 2 |
Al、Cu |
稀盐酸 |
偏向Cu |
| 3 |
Al、C(石墨) |
稀盐酸 |
偏向石墨 |
| 4 |
Mg、Al |
氢氧化钠溶液 |
偏向Mg |
| 5 |
Al、Zn |
浓硝酸 |
偏向Al |
试根据表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同(填“相同”或“不相同”)________。
(2)对实验3完成下列填空:
①铝为________极,电极反应式:______________________________。
②石墨为________极,电极反应式:___________________________。
③电池总反应式:______________________________________。
(3)实验4中铝作负极还是正极________,理由是__________________________
写出铝电极的电极反应式_________________________________。
(4)解释实验5中电流计指针偏向铝的原因:_____________________________。
反应m A+n B p C在某温度下达到平衡。
p C在某温度下达到平衡。
①若A、B、C都是气体,减压后正反应速率小于逆反应速率,则m、n、p的关系是_____________。
②若C为气体,且m+ n = p,在加压时化学平衡发生移动,则平衡必定向______方向移动。
③如果在体系中增加或减少B的量,平衡均不发生移动,则B肯定不能为_____态。
请仔细观察两种电池的构造示意图,完成下列问题: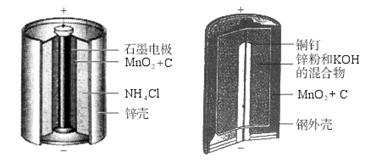
锌锰电池的构造碱性锌锰电池的构造
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O====2MnOOH+Zn(OH)2,则负极的电极反应式:_____________________________________。
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是_____________________________________。
(3)某工厂回收废旧锌锰电池,其工艺流程如下: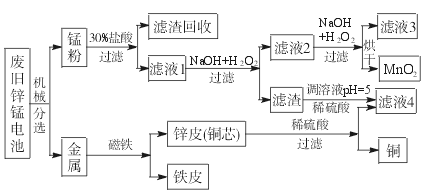
已知:生成氢氧化物的pH如下表:
| 物质 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
Mn(OH)2 |
| 开始沉淀pH |
2.7 |
7.6 |
5.7 |
8.3 |
| 完全沉淀pH |
3.7 |
9.6 |
8.0 |
8.8 |
①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2、__________。
②第一次加入H2O2后,调节pH=8.0。目的是____________________________________。
③试列举滤液4的应用实例:____________________________________________。
t℃时,将3mol A和1mol B气体通入容积为2L的密闭容器中(容积不变),发生如下反应3A(g)+B(g)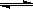 xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8mol B,并测得C的浓度为0.4mol·L-1。请填写下列空白:
xC(g),2min时反应到达平衡状态(温度不变),此时容器内剩余了0.8mol B,并测得C的浓度为0.4mol·L-1。请填写下列空白:
(1)从反应开始到平衡状态,生成C的平均反应速率为____________________。
(2) x=____。
(3)若向原平衡混合物的容器中再充入a molC,在t℃时达到新的平衡,此时B的物质的量为n(B) = ___________mol。(用含a的代数式表示)
(4)保持温度和容积不变,对原平衡混合物中三者的物质的量作如下调整,可使平衡向右移动的是______(填字母)。
A.均减半 B.均加倍 C.均增加0.4 molD.均减少0.4 mol
(5)如果上述反应在相同温度和容积的容器中进行,起始加入3 molA和3mol B,达到平衡时A的体积分数为a%。其它条件不变时,按下列配比作为起始物质,平衡时A的体积分数大于a%的是(填字母)。
A.2 molC B.1molA、3molB和4molC
C.1mol B和4molC D.6molA和2molB
(15分)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
⑴SO2和O2反应制取SO3的反应原理为:2SO2+O2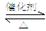 2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.
①该反应的平衡常数表达式为:.
②该反应达到平衡状态的标志是.
A.v(SO2)=v(SO3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变
⑵某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.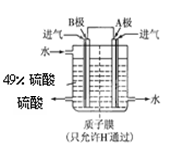
①B电极的电极反应式为;
②溶液中H+的移动方向由极到极;(用A、B表示)
⑶测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL溶液
b.量取25 mL待测液于锥形瓶中
c.用硫酸酸化的0.01 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
Fe2++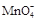 + ——Fe3++Mn2++
+ ——Fe3++Mn2++
②用硫酸酸化的KMnO4滴定终点的标志是.
③计算上述产品中FeSO4·7H2O的质量分数为.