元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据是(填序号)。
a.、、的熔点 b. 、、的氧化性
c.、、的热稳定性 d. 、、的酸性
(3)工业上,通过如下转化可制得晶体:
溶液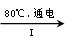 溶液
溶液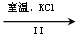 晶体
晶体
①完成I中反应的总化学方程式:□+□=□+□。
②Ⅱ中转化的基本反应类型是,该反应过程能析出晶体而无其它晶体析出的原因是。
(4)一定条件,在水溶液中1 、(=1,2,3,4)的能量()相对大小如右图所示。
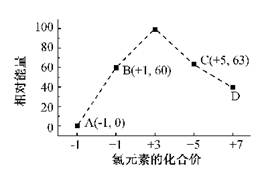
①是(填离子符号)。
②反应的热化学方程式为(用离子符号表示)。
、新的课程理念要求普及科学知识,提高公民素养,让知识走进社会、走进生活,充分体现化学的社会价值,下面是两则生活中的化学知识,请按要求作答:
(1)硅及其化合物在无机非金属材料中一直扮演着主要的角色,则:
①有下列物品或设备:a陶瓷餐具b门窗玻璃c硅太阳能电池d水晶镜片
e计算机芯片f石英光导纤维
用到硅单质的是__________(填字母标号,下同)
所用材料为SiO2或要用到SiO2的是___________
所用材料为硅酸盐的是___________
②赏心悦目的雕花玻璃是用下列物质中的一种对玻璃进行刻蚀而制成的,这种物质是:
A盐酸B氢氟酸C烧碱D纯碱
(2)病人输液用的葡萄糖注射液是葡萄糖(化学式C6H12O6)的水溶液,其标签上的部分内容如图所示,利用标签所提供的信息,回答下列问题:
①该注射液中葡萄糖的摩尔质量为:_______________
②该注射液中葡萄糖的物质的量浓度为:______________
③如果要配制一定物质的量浓度的葡萄糖溶液250ml,所需仪器除了托盘
天平、药匙、烧杯、玻璃棒、胶头滴管外,还缺少的仪器是___________
、现有下列5种气体:Cl2、CO2、SO2、NO2、NH3。试回答下列问题:
(1)超市商品琳琅满目,但摆放和布置都清晰有序,这是因为事先进行了分类处理。
对物质进行分类是我们学习和研究化学时常用的方法,采用不同的分类标准,可以对同一组物质进行不同的分类,请你填写下表:
| A组 |
B组 |
C组 |
D组 |
|
| 分类标准 |
易溶于水 |
有毒气体 |
||
| 不属于该类别的物质 |
Cl2、NO2 |
Cl2 |
(2)Cl2是一种有毒的物质,如果发生Cl2泄漏,你将采取怎样的措施?(写一条即可)
(3)管道工人曾经用浓氨水检验氯气管道是否漏气,已知能发生如下反应(在有水蒸气存在的条件下):2NH3+3Cl2=6HCl+N2,如果氯气管道某处漏气,用该方法检查时会出现的现象是_______________________
以下是元素周期表的一部分,根据给定的元素回答下列问题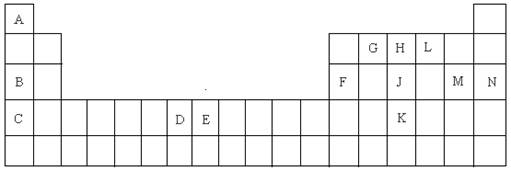
(1)K的元素符号是;
(2)D元素的外围电子排布图是,在其化合物中,最高正价是;
(3)C元素的原子结构示意图是;
(4)A与L、B与L都分别能形成原子个数比为1:1的化合物,A与L(1:1)的化合物是分子(填极性或非极性),B与L(1:1)的化合物的电子式是;
(5)G、H、L原子的第一电离能由高到低的顺序是(填元素符号);
(6)J单质的一种白色同分异构体的空间构型是;
(7)E元素在元素周期表中的位置是,在其化合物中,常有+2、+3价的2种离子,+3的离子比较稳定,其原因是;
(8)A与B的化合物的熔点比A与L的化合物的熔点高,其原因是;
(9)A的单质与L的单质与B的最高价氧化物的水化物溶液能组成燃烧电池,写出该种电池的负极的电极反应式;
(10)F元素的最高价氧化物与M元素的最高价氧化物的水化物反应的化学方程式是
。
向2 L的密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质的物质的量随时间变化如图甲所示。图乙为t2时刻后改变条件平衡体系中反应速率随时间变化的情况,且4个阶段所改变的外界条件均不相同,已知t3——t4阶段为使用催化剂。观察下图,回答下列问题: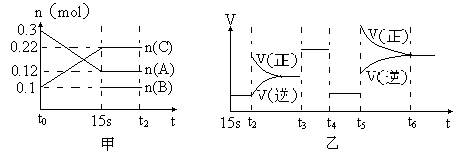
(1)甲图中从反应至达到平衡状态,生成物C的平均反应速率为。
(2)乙图中t2时引起平衡移动的条件是,t5时引起平衡移动的条件是。
(3)乙图中表示平衡混合物中,在这4个阶段中C的含量最高的一段时间是。
(4)该反应的化学方程式可以表示为:,正反应为(填“放热”或“吸热”)反应。
(5)反应开始时加入的B的物质的量为。
(1)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出222.5KJ热量,则甲烷燃烧的热化学方程式为_________________________。
(2)能证明甲烷是正四面体结构的理由是
①中心原子C采取sp3杂化,②中心原子C上没有孤对电子,
③CH2Cl2不存在同分异构体,④键角是109028,,而不是900