、、、、为短周期元素,非金属元素最外层电子数与其周期数相同,的最外层电子数是其所在周期数的2倍。在中充分燃烧能生成其最高价化合物。与具有相同的电子数。在中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)在周期表中的位置是,写出一种工业制备单质F的离子方程式。
(2)、、组成的一种盐中,的质量分数为43%,其俗名为,其水溶液与单质反应的化学方程式为;在产物中加入少量,反应后加人并振荡,有 机层显色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 |
组成和结构信息 |
| 含有的二元离子化合物 |
|
| 含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
|
| 化学组成为 | |
| 只存在一种类型作用力且可导电的单质晶体 |
的化学式为;的化学式为;的电子式为;
的晶体类型是。
(4)由和、元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为。
【化学—选修2:化学与技术】生态工业园区的建设,不仅仅是体现环保理念更要依据循环经济理论和充分考虑经济的可持续发展。下面是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产三大生态产业链流程图。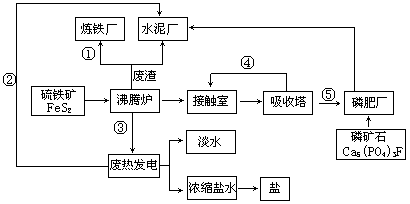
根据上述产业流程回答下列问题:
(1)从原料、能源、交通角度考虑该企业应建在
| A.西部山区 | B.沿海地区 | C.发达城市 | D.东北内陆 |
(2)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式① ,② ,③ ,④ ,⑤ 。
(3)沸腾炉发生反应的化学方程式 ,磷肥厂的产品是普钙,其主要成份是 (填化学式)。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据生态园区建设理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想 , (请写出两点)。
(10分)如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理。B在实验时才插入溶液中。
(1)从装置的特点判断,甲、乙装置中 是原电池,其负极的电极反应式为: ;
(2)实验开始后,(乙)装置中有关电极反应是:C: ;D: ,D电极上的现象是 ,一段时间后溶液中的现象是 ;
(3)在实验(2)的基础上,改变两装置电极的连接方式,A接D、B接C,此时D极上发生的电极反应式为: ,乙装置里除两电极上有明显的现象外,还可以看到的现象是 ,产生该现象的化学反应方程式是 。
(10分)高纯度氧化铝有广泛的用途,某研究小组用以下流程制取高纯度氧化铝:
根据上述流程图填空:
(1)“除杂”操作是加入过氧化氢后,用氨水调节溶液的pH约为8.0,以除去硫酸铵溶液中的少量Fe2+。请写出在除去Fe2+离子的过程中,发生的主要反应的离子方程式 。
(2)配制硫酸铝溶液时,需用硫酸酸化,酸化的目的是 。
(3)“结晶”这步操作中,母液经蒸发浓缩至溶液表面刚出现薄层晶体即停止加热,然后冷却结晶,得到铵明矾晶体(含结晶水)。母液不能蒸干的原因是 。
(4)“分离”操作的名称是 (填字母代号)。
A.蒸馏 B.分液 C.过滤
(5)铵明矾晶体的化学式为NH4Al(SO4)2•12H2O,在0.1mol/L铵明矾的水溶液中,离子浓度最大的离子是 ,离子浓度最小的离子是 。
(10分)有两个起始体积相同的密闭容器A和B,A容器有一个可移动的活塞,能使容器内保持恒压;B容器为固定体积。起始时这两个容器分别充入等量的体积比为2∶1的SO2和O2的混合气,并使A、B容器中气体体积相等,并保持在400℃条件下发生反应2SO2+O2 2SO3,并达到平衡。
2SO3,并达到平衡。
(1) 达到平衡所需时间,A容器比B容器___________,两容器中SO2的转化率A比B______________。
(2) 达到(1)所述平衡后,若向两容器中分别通入数量不多的等量Ar气体,A容器的化学平衡向________移动,B容器的化学平衡____________移动。
(3) 达到(1)所述平衡后,若向容器中通入等量的原混合气体,重新达到平衡后,A容器中SO3的体积分数________________,B容器中SO3的体积分数__________________(填变大、变小、不变)。
甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
| 化学键 |
H-H |
C-O |
C   O O |
H-O |
C-H |
| E/(kJ.mol-1) |
436 |
343 |
1076 |
465 |
413 |
已知反应①中的相关的化学键键能数据如下:
由此计算△H1= kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3= kJ.mol-1
A.99、-41 B.+99 、+41 C.-99 、+41 D.-99、41