(10分)如图所示是某化学兴趣小组设计的趣味实验装置图,图中A、D均为碳棒,B铝棒,C为铁棒,所用甲、乙容器中的溶液事前均采取了煮沸处理。B在实验时才插入溶液中。

(1)从装置的特点判断,甲、乙装置中 是原电池,其负极的电极反应式为: ;
(2)实验开始后,(乙)装置中有关电极反应是:C: ;D: ,D电极上的现象是 ,一段时间后溶液中的现象是 ;
(3)在实验(2)的基础上,改变两装置电极的连接方式,A接D、B接C,此时D极上发生的电极反应式为: ,乙装置里除两电极上有明显的现象外,还可以看到的现象是 ,产生该现象的化学反应方程式是 。
如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置。
请回答:
(1)实验步骤:①____________________________________________________________;
②在各装置中注入相应的试剂(如图所示);
③________________________________________________________________________;
实验时,烧瓶中液体混合物逐渐变黑。
(2)能够说明乙烯具有还原性的现象是
________________________________________________________________________
________________________________________________________________________;
装置甲的作用是_____________________________________________________________。
若无此装置,是否也能检验乙烯具有还原性,简述其理由:
________________________________________________________________________
________________________________________________________________________。
如图所示,某同学做乙醇氧化实验时,将螺旋状铜丝先放到a点处加热,然后再移到b点,发现铜丝在火焰a、b两点现象明显不同。请你写出a、b两点的实验现象,并解释产生该现象的原因。
| 实验现象 |
解释 |
化学方程式 |
|
| a |
|||
| b |
为了测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验。可供选用的实验仪器如图所示。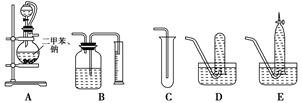
请回答以下问题:
(1)测量氢气体积的正确装置是________(填写编号)。
(2)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填写编号)。
A.防止无水酒精挥发
B.保证实验装置不漏气
C.使无水酒精容易滴下
(3)实验前预先将小块钠在二甲苯中熔化成小钠珠,冷却后倒入烧瓶中,其目的是
________________________________________________________________________。
(4)已知无水酒精的密度为0.789 g·cm-3,移取2.0 mL酒精,反应完全后(钠过量),收集390 mL气体。则乙醇分子中能被钠取代出的氢原子数为________,由此可确定乙醇的结构式为________________而不是____________________________________________________。
(5)实验所测定的结果偏高,可能引起的原因是________(填写编号)。
A.本实验在室温下进行
B.无水酒精中混有微量甲醇
C.无水酒精与钠的反应不够完全
某溶液中可能含有CO32-、SO42-、HCO3-三种离子中的一种或两种。为探究其组成,小明取出两份相同的样品溶液于试管中,向一份中加入过量的盐酸,产生无色气泡;向另一份中滴加过量的氯化钡溶液,产生白色沉淀。请设计合理实验,在小明实验的基础上做进一步的实验,对小明的实验给出结论。
仅限选择的仪器、用品和试剂:烧杯、试管、玻璃棒、胶头滴管、量筒、集气瓶、铁架台、漏斗、滤纸、酒精灯;1 mol·L-1硫酸;2 mol·L-1盐酸;2 mol·L-1硝酸;1 mol·L-1氯化钡溶液、澄清石灰水、蒸馏水。
完成下列探究过程:
(1)提出假设:
假设1:溶液中只存在CO32-。
假设2:____________________________________________________________________。
假设3:____________________________________________________________________。
假设4:溶液中存在SO42-、HCO3-。
(2)基于假设4,设计出实验方案,将实验操作、预期的实验现象和结论填在下表中(可不填满)。
| 步骤编号 |
实验操作 |
预期现象和结论 |
| ① |
||
| ② |
||
| ③ |
||
| ④ |
牙膏是生活必需品。下面是牙膏中某些主要成分的检验流程图: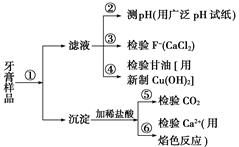
请回答下列问题:
(1)在①中加水、搅拌、静置后,接下来的实验操作名称是________,所需要的主要玻璃仪器有________________________________________________________________________。
(2)在②中用pH试纸测溶液的pH的操作方法是
________________________________________________________________________
________________________________________________________________________。
(3)写出④中发生反应的化学方程式
________________________________________________________________________
________________________________________________________________________。
(4)在⑥中检验Ca2+的存在,除可用焰色反应外,还可利用Ca2+和________溶液的反应来进行。