不能作为判断硫、氯两种元素非金属性强弱的依据是
| A.单质沸点的高低 |
| B.单质氧化性的强弱 |
| C.单质与氢气化合的难易 |
| D.最高价氧化物对应的水化物酸性的强弱 |
在通常条件下,下列各组物质的性质排列正确的是
| A.密度:CH3CH2CH2Cl>CH3CH2Cl>CH3Cl |
| B.热稳定性:HF>H2O>NH3 |
| C.还原性:HF>HCl>HBr>HI |
| D.水溶性: HCl>H2S> SO2 |
下列各项中表达正确的是
A.H2O2的电子式: 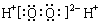 |
B.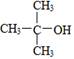 的命名:2,2—二甲基—2—乙醇 的命名:2,2—二甲基—2—乙醇 |
| C.常温下,浓度都为0.1mol·Lˉ1的Na2CO3、NaHCO3溶液的pH,前者小于后者 |
D.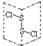 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键,是极性分子 为二氯化二硫(S2Cl2)的结构,分子中有极性键、非极性键,是极性分子 |
化学与新型材料、环境保护、能源开发等密切相关。下列说法错误的是
| A.使用生物酶降解生活废水中的有机物,可防止水体的富营养化 |
| B.人造纤维、合成橡胶和光导纤维都属于有机高分子化合物 |
| C.上海世博会很多展馆采用光电转化装置,体现当今“低碳”经济的理念 |
| D.利用二氧化碳等原料合成的聚碳酸酯类可降解塑料有利于减少白色污染 |
把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁;另一份加入含b mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡。则原混合溶液中钾离子的浓度为
A. 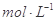 |
B.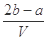 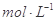 |
C.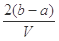 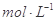 |
D. 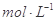 |