下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| |
|
|
|||||||||||||||
| |
|
|
|
|
a |
|
b |
|
|||||||||
| |
|
c |
|
|
d |
e |
|
||||||||||
| |
|
|
|
|
|
|
|
f |
|
g |
|
|
|
|
|
|
|
试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: 。
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) 。
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f 3+ 的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
(5)c单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。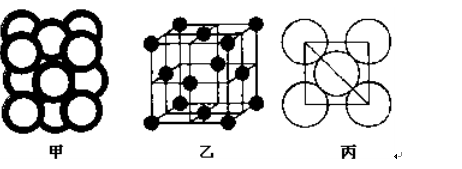
c单质晶体中原子的配位数为 。若已知c的原子半径为r,NA代表阿伏加德罗常数,c的相对原子质量为M。该晶体的密度为 (用字母表示)。
【改编】(18分)能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应平衡常数表达式为 。该反应能量转化方式为 。
(2)CH3OH、O2和KOH溶液构成的燃料电池的负极电极反应式为 。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。
①电解过程中发生反应的离子方程式是 ,阴极附近溶液PH (填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,证明SO42‾已经完全沉淀的方法是 。
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式 。
③图中氢氧化钠溶液的质量分数a% b%(填“>”、‘‘=”或“<”),,燃料电池中正极上发生的电极反应为 。
选做题结构决定性质,性质体现结构。对结构和性质的研究是学好化学的基础。
(1)科学家通过X射线探明,KCl、MgO、CaO的晶体结构与NaCl的晶体结构相似(图a所示)。KCl、CaO、MgO三种离子晶体熔点从高到低的顺序是
(2)某晶体的晶胞如图所示,X位于体心,Y位于4个面心,Z位于8个顶点,该晶体中 X、Y、Z的粒子个数比为______________;
(3)乙二胺(H2N-CH2-CH2-NH2)和三甲胺[N(CH3)3]均属于胺,但乙二胺比三甲胺的沸点高的多,原因是 。
(4)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出CN-的等电子体的分子式__________(写出1个)
(5)NH4CuSO3中的金属阳离子的核外电子排布式为 。
某混合物的水溶液,可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现分别取100 mL的两等份溶液进行如下实验:
①第一份加过量NaOH溶液后加热,收集到0.02 mol气体,无沉淀生成,同时得到溶液甲。
②向甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、干燥、灼烧后,得到1.02 g固体。
③第二份加足量BaCl2溶液后,生成白色沉淀,沉淀经足量盐酸洗涤、干燥后,得到11.65 g固体。
依据实验回答下列问题:
(1)由①可知一定存在的离子为 ,其浓度为 mol·L-1。
(2)写出②中产生沉淀的离子方程式 。
(3)由③可知一定存在的离子为 ,其浓度为 mol·L-1。
(4)综合上面三个实验,该混合物的水溶液中一定不存在的离子是 (填离子符号)。
(5)某同学通过分析认为该溶液中一定存在K+,他的理由是 。
有机物D是一种合成抗高血压药的重要通用中间体,其合成路线如下:(已知A是一种芳香酸)
(1)A、C的结构简式分别是 、 。D中含有的含氧官能团名称是 。
(2)C→D的反应类型是 。
(3)加热条件下,C在足量NaOH水溶液中反应的化学方程式是 。
(4)E是一种相对分子质量比A小14的芳香酸。写出满足下列条件的E的所有同分异构体的结构简式: 。
①能发生银镜反应
②一定条件下可发生水解反应
③分子的核磁共振氢谱中有四组峰。
(5)F是B在碱溶液中水解后再酸化的产物。F在一定条件下可聚合成高分子化合物,写出该反应的化学方程式 。
【改编】工业上由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备无水AlCl3的流程如下:
已知:AlCl3,FeCl3,分别在183℃、315℃升华
(1)在焙烧炉中发生反应:
①Fe2O3(s)+3C(s) 2Fe(s)+3CO(g) △H=-492.7kJ/mol
2Fe(s)+3CO(g) △H=-492.7kJ/mol
②3CO(g)+ Fe2O3(s) 2Fe(s)+3CO2(g) △H=+25.2kJ/mol
2Fe(s)+3CO2(g) △H=+25.2kJ/mol
反应2Fe2O3(s)+3C(s) 4Fe(s)+3CO2(g) △H=___________kJ/mol。
4Fe(s)+3CO2(g) △H=___________kJ/mol。
(2)①Al2O3,Cl2和C在氯化炉中高温下发生反应,反应方程式为_____________,当反应掉2molAl2O3时需要焦炭________g,转移______mol电子;该制备流程中可以循环使用的物质有________________;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为_______。在温度约为700℃向升华器中加入铝粉,发生反应的化学方程式为 。充分反应后温度降至_____以下(填“183℃、315℃之一),开始分离收集AlCl3。
②AlCl3溶于水后得到溶液显_______性(填“酸性、碱性”之一)为什么?_______________________,为得到AlCl3·3H2O会使用浓硫酸进行蒸馏,也能得到一定量的无水AlCl3,此原理是利用浓硫酸下列性质中的 (填字母序号)。
①氧化性 ②吸水性 ③难挥发性 ④脱水性
a.只有①b.只有②c.只有②③d.只有②③④
(3)根据二氧化碳既不能燃烧,也不能支持燃烧的性质,人们研制了泡沫灭火器,灭火器内有两个容器,分别盛放两种液体,它们是Al2(SO4)3和NaHCO3溶液,两种溶液互不接触,不发生任何化学反应。(平时千万不能碰倒泡沫灭火器)当需要泡沫灭火器时,把灭火器倒立,两种溶液混合在一起,就会产生大量的二氧化碳气体,请写出相关化学方程式:_____________________;若灭火器中盛装了153.9g的硫酸铝与足量的碳酸氢钠,试问理论上可以放出CO2____________L(标准状况下)