(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是 。
(2)将2.4mol某金属投入某酸溶液中,恰好完全反应,并产生7.2g氢气,则此金属化合价为 。
(3)某同学为探究铜铁合金中铁的质量分数,先后进行了三次实验,实验数据如下:
| 实验次数 项目 |
第一次 |
第二次 |
第三次 |
| 所取合金的质量/g |
20 |
20 |
40 |
| 所加稀硫酸的质量/g |
100 |
120 |
80 |
| 生成氢气的质量/g |
0.4 |
0.4 |
0.4 |
①该合金中铁的质量分数是 %(结果精确到1%)。
②本实验中所加稀硫酸的溶质的质量分数为 %(结果精确到0.1%)。
(每空2分,共8分)有A、B、C、D四种溶液,它们各为K2CO3、K2SO4、NaHSO4、Ba(NO3)2中的一种。现进行下列实验:A+C无明显变化;A+D无明显变化;B+D生成溶液及沉淀物E;B+C生成溶液F及沉淀;少量E溶于过量F中,生成 溶液并放出气体。
溶液并放出气体。
(1).写出NaHSO4的电离方程式_________________________________;
(2).写出下列物质的化学式:
A是__________ B是__________ D是_________
(每空2分,共8分)按要求写出下列反应的离子方程式或化学方程式:
⑴写出离子反应方程式CO2+2OH-=CO32-+H2O所对应的两个化学方程式
①
②
⑵书写下列反应的离子方程式:
①氧化铜与稀盐酸反应 :
②CO2通入到足量的澄清石灰水:
⑴在K2Cr207+14HCl=2KCl+2CrCl3+3Cl2↑+7H20反应中,元素被氧化,元素发生还原反应;是氧化产物;若0.1 mol K2Cr207完全反应,则被氧化的HCl的分子数目为
⑵用双线桥法表示该反应的电子转移的方向和数目:
K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O
.相同物质的量的CO2和O2,其所含原子数目之比为______________,所含氧原子数目之比为________________,相同条件下的密度之比为________________;质量相同的CO2和O2,其物质的量之比为________________。
在一定条件下,xA + yB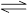 zC,达到平衡,试填写下列空白:
zC,达到平衡,试填写下列空白:
( 1 ) 若A、B、C都是气体,减压后向逆反应方向移动,则x、y、x之间的关系是 。
( 2 ) 已知C是气体,且x+y=z,加压时平衡如果发生移动,则平衡必向 方向移动,且A、B的状态中至少有一种是___________________。
( 3 ) 若B、C是气体,其他条件不变时增加A的用量,平衡不移动,则A的状态为 。
( 4 ) 加热后C的百分含量减少,则正反应是反应(选填“吸热”、“放热”)。