(本题16分)硫酸铜是一种应用极其广泛的化工原料。以下是某工厂用含铁废铜为原料生产胆矾(CuSO4•5H2 O)和副产物石膏(CaSO4•2H2O)的生产流程示意图:
胆矾和石膏在不同温度下的溶解度(g/100g水)见下表:
| 温度(℃) |
20 |
40 |
60 |
80 |
100 |
| 石膏 |
0.32 |
0.26 |
0.15 |
0.11 |
0.07 |
| 胆矾 |
32 |
44.6 |
61.8 |
83.8 |
114 |
请回答下列问题:
(1)红棕色滤渣的主要成分是____________。
(2)写出浸出过程中生成硫酸铜的离子方程式 _______________________________。
(3)操作I包括加热升温、控制温度在_______℃、蒸发结晶、__________等操作。
(4)从溶液中分离出硫酸铜晶体的操作Ⅱ应为_________、过滤、洗涤、干燥;
(5)用无水乙醇洗涤晶体而不用蒸馏水的原因是________________________________;
(6)取样检验是为了确认Fe3+是否除净。有同学设计了以下两种方案,在实验室分别对所取样品进行以下操作:
方案一:取样于试管→滴加KSCN溶液;方案二:纸上层析后→喷KSCN溶液;
①你认为上述两种方案设计更合理的是_____________;
②指出你认为不合理的方案存在的问题_____________________________________。
氮元素可以形成多种化合物。
回答以下问题:
(1)基态氮原子的价电子排布式是。
(2)
、
、
三种元素第一电离能从大到小的顺许昌是。
(3)肼(
)分子可视为
分子中的一个氢原子被-
(氨基)取代形成的另一种氮化物。
①
分子的空间构型是;
分子中氮原子轨道的杂化类型是。
②肼可用作火箭燃料,燃烧时发生的反应是:
若该反应中有4
键断裂,则形成的
键有
。
③肼能与硫酸反应生成
。
晶体类型与硫酸铵相同,则
的晶体内不存在(填标号)
| A. |
a.离子键 b.共价键 c.配位键 d.范德华力 |
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体得4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物是别的是(填标号)。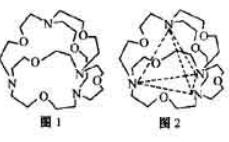
a.
b.
c.
d.
四氧化钛(
)是制取航天航空工业材料--钛合金的重要原料。由钛铁矿(主要成为是
)制备
等产品的一种工艺流程示意如下:
回答下列问题
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
(无色)+ = (紫色)+
(紫色)+ (无色)+
加入铁屑的作用是。
(2)在②→③工艺过程中需要控制条件以形成 溶胶,该溶胶的分散质颗粒直径大小在范围。
(3)若把③中制得的固体 用酸清洗除去其中的Fe(OH)3杂质,还可制得钛白粉。已知25 ℃时, ,该温度下反应 的平衡常数K=。
(4)已知:
写出④中 和焦炭、氯气反应生成液态 和 气体的热化学方程式:。
(5)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是(只要求写出一项)。
(6)依据下表信息,要精制含少量SiCl4杂质的TiCl4,可采用方法。
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
I.磷、硫元素的单质和化合物应用广泛。
(1)磷元素的原子结构示意图是。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500°C生成白磷,反应为:
每生成 1
时,就有
电子发生转移。
(3)硫代硫酸钠(
)是常用的还原剂。在维生素C(化学式
)的水溶液中加入过量
溶液,使维生素 完全氧化,剩余的
用
溶液滴定,可测定溶液中维生素C的含量。发生的反应为:
在一定体积的某维生素C溶液中加入
溶液
,充分反应后,用
溶液滴定剩余的
,消耗
溶液
.该溶液中维生素C的物质量是
。
(4)在酸性溶液中,碘酸钠(
)和亚硫酸钠可发生如下反映:
生成的碘可以用淀粉液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
该实验的目的是;表中
ML。
II稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)钵(Ce)是地壳中含量最高的稀土元素,在加热条件下
易发生水解,无水
,可用加热
和
固体混合物的方法来制备。其中,
的作用是。
(6)在某强酸性混合稀土溶液中加入
,调节
≈3.
通过下列反应形成Ce
(OH)4沉淀得以分离。完成反应的离子方程式:
+
+
=
+
臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)
与KI溶液反应生成的两种单质是和.(填分子式)
(2)
在水中易分解,一定条件下,
的浓度减少一半所需的时间(t)如表所示。已知:
的起始浓度为0.0216
。
①
增大能加速
分解,表明对
分解起催化作用的是.
②在30°C、
=4.0条件下,
的分解速率为
。
③据表中的递变规律,推测
在下列条件下分解速率依次增大的顺序为.(填字母代号)
. 40°C、
="3.0" b. 10°C、
="4.0" c. 30°C、
=7.0
(3)
可由臭氧发生器(原理如图)电解稀硫酸制得。
①图中阴极为(填"
"或"
"),其电极反应式为.
②若C处通入
,则
极的电极反应式为.
③若C处不通入
,
、
处分别收集到 L和有
L和有 L气体(标准情况),则E处收集的气体中
所占的体积分数为.(忽略
的分解)。
L气体(标准情况),则E处收集的气体中
所占的体积分数为.(忽略
的分解)。
食品添加剂必须严格按照食品安全国家标准(
2760-2011)的规定使用。作为食品添加剂中的防腐剂G和W,可经下列反应路线得到(部分反应条件略)。
(1)
的制备
①
与苯酚在分在组成上相差一个
原子团,他们互称为;常温下
在水中的溶解度比苯酚的(填"大"或"小").
②经反应
 和
和
 保护的官能团是.
保护的官能团是.
③
 的化学方程式为.
的化学方程式为.
(2)
的制备
①
→
为加成反应,
的结构简式为。
②
→
的反应中,
分子中形成了新的(填"
键"或"
键" )。
③用
的同分异构体
制备 ,为避免
+
,为避免
+
 +
发生,则合理的制备途径为酯化、、.(填反应类型)
+
发生,则合理的制备途径为酯化、、.(填反应类型)
④应用
的原理,由
制备
的反应步骤为
第1步:;第2步:消去反应;第3步:.(第1、3步用化学方程式表示)