(本题16分)为证明Fe3+具有较强的氧化性,甲同学做了如下实验:将Cu片放入Fe(NO3)3溶液中,观察到Cu片逐渐溶解,溶液由黄色变为蓝绿色,由此甲同学得到Fe3+具有较强氧化性的结论。
乙同学提出了不同的看法:“Fe(NO3)3溶液具有酸性,在此酸性条件下NO3-也能氧化Cu”,并设计实验进行探究。
已知:
| 水解反应 |
平衡常数(K) |
Fe3+ + 3H2O  Fe(OH)3 + 3H+ Fe(OH)3 + 3H+ |
7.9 × 10-4 |
Fe2+ + 2H2O  Fe(OH)2 + 2H+ Fe(OH)2 + 2H+ |
3.2 × 10-10 |
Cu2+ + 2H2O  Cu(OH)2 + 2H+ Cu(OH)2 + 2H+ |
3.2 × 10-7 |
请回答:
(1)稀硝酸和Cu反应的化学方程式为 。
(2)请利用所提供的试剂,帮助乙同学完成实验方案设计。
试剂:0.5mol/L Fe(NO3)3溶液、Cu片、精密pH试纸(0.5~5.0)、稀硝酸
方案: 。
(3)丙同学分别实施了甲、乙两位同学的实验方案,并在实验过程中用pH计监测溶液pH的变化,实验记录如下。
| 实验内容 |
实验现象 |
| 甲同学的实验方案 |
溶液逐渐变成蓝绿色, pH略有上升 |
| 乙同学的实验方案 |
无明显现象,pH没有明显变化。 |
①根据实验现象写出发生反应的离子方程式: 。
②导致实验过程中溶液pH略有上升的可能原因是 。
(4)请你设计更简便可行的实验方案,帮助甲同学达到实验目的: 。
如图所示,甲、乙两装置电极材料都是铁棒与碳棒,请回答下列问题: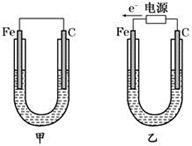
(1)若两装置中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲装置中的________棒,乙装置中的________棒。
②乙装置中阳极的电极反应式是:_______________________________。
(2)若两装置中均为饱和NaCl溶液:
①写出乙装置中总反应的离子方程式:_____________________________。
②甲装置中碳极的电极反应式是,乙装置碳极的电极反应属于________(填“氧化反应”或“还原反应”)。
③将湿润的淀粉KI试纸放在乙装置碳极附近,发现试纸变蓝,解释其原因:。
为达到下表中的实验目的,请选择合适的试剂及实验方法,将其标号填入对应的空格。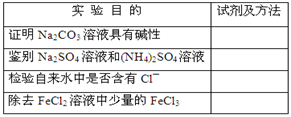
供选择的化学试剂及实验方法
| A.加入足量铁粉,过滤 |
| B.滴加酚酞试液,观察现象 |
| C.加稀HNO3和AgNO3溶液,观察现象 |
| D.加入NaOH浓溶液加热,观察现象 |
化学兴趣小组为探究某铁矿石(主要成分为Fe2O3和SiO2)的性质,进行如下实验: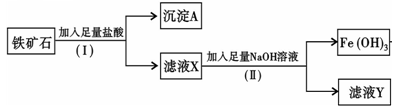
(1)步骤(I)中分离溶液和沉淀的操作名称是;
(2)沉淀A中一定含有,该物质属于(填“酸性”或“碱性”)氧化物;
(3)往滤液Y中加入KSCN溶液,溶液呈(填“黄色”或“红色”)
(4)写出步骤(Ⅱ)中生成Fe(OH)3的离子方程式。
完成下列各题
(1)工业上以氯气和石灰乳为原料制造漂白粉,漂白粉的有效成分是 __(填“CaCl2”或“Ca(ClO)2”)。
(2)某些合成染发剂含有对苯二胺(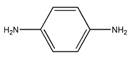 ),有一定的致癌作用。对苯二胺属于(填“有机物”或“无机物” )。
),有一定的致癌作用。对苯二胺属于(填“有机物”或“无机物” )。
取50.0mL K2CO3和K2SO4的混合溶液,加入过量BaCl2溶液后得到12.18g白色沉淀,用过量稀硝酸处理后沉淀量减少到2.33g,并有气体放出。试计算:
(1)原混合溶液中c(K2CO3) =;c(K2SO4) =;
(2)产生的气体在标准状况下的体积为。