(15分)Ⅰ:工业上用CO2和H2在一定条件发生如下反应合成甲醇并放出大量的热:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH1 回答下列问题。
CH3OH(g)+H2O(g) ΔH1 回答下列问题。
(1)已知:2H2(g)+O2(g)=2H2O(g) ΔH2
则反应2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ΔH= (用含ΔH1、ΔH2表示)
(2)若反应温度升高,CO2的转化率 (填“增大”“减小”或“不变”)。
(3)写出在酸性环境中,甲醇燃料电池中的正极反应方程式
Ⅱ:生产甲醇的原料H2可用如下方法制得:CH4(g) + H2O(g)  CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
CO(g) + 3H2(g),一定温度下,将2 mol CH4和4 mol H2O通入容积为10L的密闭反应室中,反应中CO的物质的量浓度的变化情况如图所示,请回答下列问题:
(4)反应进行到4分钟到达平衡。请计算从反应开始到刚刚平衡,平均反应速率v(H2)为 ;并求此反应在此温度下的平衡常数(在答题卡对应的方框内写出计算过程)。
(5)在第5分钟时将容器的体积瞬间缩小一半后,若在第8分钟时达到新的平衡(此时CO的浓度约为0.25 mol·L—1 ),请在图中画出第5分钟后H2浓度的变化曲线。
(1)白色的Fe(OH)2在空气中发生的颜色变化为________________________;
(2)写出硅酸钠溶液在空气中变质的化学方程式:____________________________;
(3)写出用熟石灰吸收氯气制漂白粉的化学方程式:;
(4)将CaMg3Si4O12改写为氧化物的形式:__________________________________。
电解原理在化学工业中有广泛应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: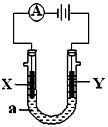
(1)若X、Y都是惰性电极,a是AgNO3溶液,实验开始时,同时在两边各滴入几滴石蕊试液,则
①电解池中X极上的电极反应式为,
②Y电极上的电极反应式为,
在Y极附近观察到的现象是。
③电解总反应方程式为。
(2)要在铁件的表面镀铜防止铁被腐蚀,则:
① Y电极的材料是,电极反应式是。
电解液a选用溶液。电解过程中其浓度(增大、减小或不变)
②若电镀前X、Y两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12 g,则电镀时电路中通过的电子为______mol。
③镀层破损后,镀铜铁比镀锌铁更容易被腐蚀,请简要说明原因:
(8分)某同学用铅蓄电池作电源,用石墨做电极电解500 mL某浓度的CuSO4溶液,观察到A电极表面有红色固体物质生成,当溶液中原有溶质完全电解后,停止通电,取出A电极,洗涤、干燥、称量,电极增重1.6 g。已知铅蓄电池的工作原理为:
Pb+PbO2+2H2SO4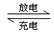 2PbSO4+2H2O
2PbSO4+2H2O
请按要求回答下列问题:
(1)电解CuSO4溶液的化学方程式 ,
(2)当反应过程中转移的电子为0.02mol时,铅蓄电池内消耗硫酸的物质的量为mol。
(3)电解前CuSO4溶液的物质的量浓度为。
(4)若电解前后溶液的体积不变,电解后溶液的pH=
(5)写出铅蓄电池负极的电极反应式:
(1) 根据所学化学反应原理填空:
①升高温度时,水的pH(填“增大”“减小”或“不变 ”)
”)
②体积、pH均相同的盐酸 和醋酸溶液,中和等浓度的NaOH溶液时所需体积分别为V1、V2 。则V1V2(填“<”、“>”或“=”)
和醋酸溶液,中和等浓度的NaOH溶液时所需体积分别为V1、V2 。则V1V2(填“<”、“>”或“=”)
③某反应放热且熵增加,该反应自发进行(用“能”或“不能”表示)
(2)依据事实,用化学用语填空:
①1 mol NO2气体与水完全反应生成硝酸溶液和NO气体,放出热量4 6 kJ。该反应的热化学方程式______________________________________。
6 kJ。该反应的热化学方程式______________________________________。
②用离子方程式表示氯化铵溶液的酸碱性:_。
③用离子方程式表示向碳酸镁沉淀中加入NaOH溶液后的沉淀转化:
。
(6分)人工合成的香料茉莉酮,其结构如图所示。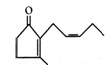
(1)该有机物的碳原子数为,化学式为
(2)该有机物的官能团有(写名称)。