某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为两者反应只生成CuCO3一种沉淀:
乙同学认为这两者相互促进水解反应,生成Cu(OH)2一种沉淀同时还有一种气体;
丙同学诀为生成CuCO3和Cu(OH)2两种沉淀。
(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
I.按照乙同学的理解Na2CO3溶液和CuSO4溶液反应的离子反应方程式为: ;
在探究沉淀物成分前,须将沉淀从溶液中分离并净化,主要有三步操作,它们是 ;
II.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。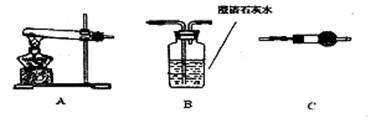
(1)各装置连接顺序为 → → 。
(2)装置C中装有的试剂名称是 。
(3)能证明生成物中有CuCO3的实验现象是 。
氨气是一种化工原料。
(1)请写出工业上合成氨的化学方程式:
(2)实验室中,甲、乙两小组选择了不同方法制取氨气,请将实验装置的字母编号和制备原理填写在下表空格中。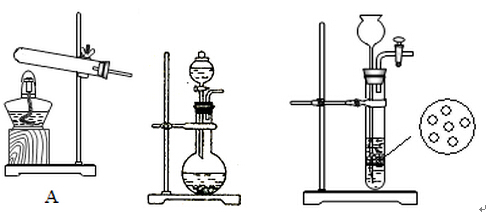
B C
| 实验装置 |
实验药品 |
制备原理 |
|
| 甲小组 |
A |
反应的化学方程式为 ① |
|
| 乙小组 |
浓氨水、氢氧化钠固体 |
氢氧化钠的作用:氨水中存在平衡: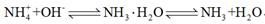 ,NaOH固体溶于水,使溶液中c(OH-)增大,平衡向右移动,且NaOH固体溶于水时放热,溶液温度升高,平衡向右移动。 ,NaOH固体溶于水,使溶液中c(OH-)增大,平衡向右移动,且NaOH固体溶于水时放热,溶液温度升高,平衡向右移动。 |
(3)请设计一个操作简单的实验,验证NH3·H2O是弱电解质。
。
(4)甲同学把制得的氨气溶于适量水中,得到稀氨水,用标准浓度的盐酸滴定,测定其浓度。实验步骤:准确量取10.00mL稀氨水于锥形瓶中,加入20mL水稀释,滴加溶液作为指示剂(填“石蕊”、“酚酞”或“甲基橙”),将(填“0.020”、“0.05”、“0.1980”或“1.5”)mol•L-1盐酸装入50ml酸式滴定管,滴定至,停止滴定,记录数据。重复滴定2次。平均消耗盐酸Vml。计算原稀氨水的物质的量浓度
=(只列出算式,不做运算)
铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上用铝土矿制备铝的某种化合物的工艺流程如下。
(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。
①检验滤液B中是否还含有铁元素的方法为:(注明试剂、现象)。
②将滤液B中的铝元素以沉淀形式析出,可选用的最好试剂为(填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
③由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、冷却结晶、
(填操作名称)、洗涤。
④该过程中涉及某氧化还原反应如下,请完成配平:
Fe2++ClO-+ = Fe(OH)3↓+ C1-+
(2)SiO2和NaOH焙烧制备硅酸钠,可采用的装置为(填代号)。
乙二酸通常以二水合物的形式存在,俗称草酸晶体.已知草酸晶体在101℃时熔化并开始升华,157℃时大量升华,继续升温会分解生成CO、CO2和H2O.
(1)下列关于乙二酸的叙述正确的是(填编号)________________.
①能和乙二醇发生酯化反应②能使酸性高锰酸钾溶液褪色
③其溶液能使蓝色石蕊试纸变红④能和碳酸氢钠溶液反应生成气体
(2)乙二酸的工业生产方法之一是以乙二醇为原料,在一定条件下,用空气氧化得到.写出该反应的化学反应方程式 :_____________________________________________________________________。
(3)欲检验草酸晶体受热分解的产物中是否有CO2,甲、乙两位同学分别设计了装置1、装置2来完成实验.
(I)简述检验装置1气密性的操作方法 :_________________________________________________。
(II)B和E两个装置中更合理的是________,理由为: __________________________________。
(III)请从A~F中选择合适的仪器,组装一套可更好达到实验目的装置,按照气流由左到右的顺序依次为(用字母表示):_________________。
(Ⅳ)一定条件下草酸氢铵分解生成NH3、CO、CO2和H2O,110℃时将该混合气体先通过Na2O2,再通过浓硫酸分别增重Ag和Bg ; 若将混合气体先通过浓硫酸,再通过Na2O2分别增重Cg和Dg(能反应的气体均可吸收完全,且该条件下CO与Na2O2不反应),则A、B、C、D的大小关系为:
___________________________。
(10分)信息时代产生的大量电子垃圾对环境构成严重威胁。某研究性学习小组将一批废弃的线路板简单处理后,得到含Cu、Fe及少量Au、Pt等金属的混合物,并用如下流程制备胆矾晶体(CuSO4•5H2O):
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 |
Fe3+ |
Fe2+ |
Cu2+ |
| 开始沉淀 |
1.5 |
6.4 |
4.2 |
| 完全沉淀 |
3.2 |
8.9 |
6.7 |
(1)滤渣Ⅰ的主要成份是(写化学式)__________。
(2)反应Ⅱ中加入H2O2的作用是___________________。
(3)生成沉淀反应的离子方程式有______________________。
(4)操作Ⅰ的步骤是、过滤、洗涤、干燥。
(5)测定胆矾晶体纯度的实验步骤如下:
A. 准确称取3.125g胆矾晶体样品配成100mL溶液;
B. 取10.00 mL溶液于带塞锥形瓶中,加适量水稀释,加入过量KI固体,发生反应:2Cu2+ +4Iˉ=2CuI↓ + I2
C. 继续向上述混合物中,逐滴加入0.1000 mol·L-1Na2S2O3溶液至恰好完全反应,共消耗12. 00mL Na2S2O3溶液:I2+2S2O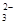 = 2Iˉ+S4O
= 2Iˉ+S4O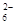 , 则样品中胆矾晶体的质量分数______。
, 则样品中胆矾晶体的质量分数______。
下列装置和操作正确的是 ( )