W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为14,中子数为7;X的离子与N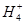 具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。
具有相同的质子、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强。
(1)Y在周期表中的位置是 。
(2)用电子式表示化合物X3W的结
构 。
(3) X3W遇水可释放出使酚酞溶液变红的气体A,该
反应的化学方程式是 。
(4)同温同压下,将a L W的简单氢化物和b LZ的氢化物通入水中,若所得溶液的pH=7则a b(填“>”或“<”或“=”)。
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是 。
(6)已知W的单质与气体B在一定条件下可形成气体A,即:
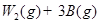
 △H=—92.4kJ·mo1-1
△H=—92.4kJ·mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应。在不同时间测定的容器内各物质的浓度如下表:
| 时间 |
浓度(mo1/L) |
||
| c(W2) |
c(B) |
c(A) |
|
| 第0 min |
4.0 |
9.0 |
0 |
| 第10 min |
3.8 |
8.4 |
0.4 |
| 第20 min |
3.4 |
7.2 |
1.2 |
| 第30 min |
3.4 |
7.2 |
1.2 |
| 第40 min |
3.6 |
7.8 |
0.8 |
0min~10min, W2 的平均反应速率 。
②反应在第l0min改变了反应条件,改变的条件可能是 。
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是 。
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度
以石油裂解产物丙烯为原料合成一些新物质的路线如下。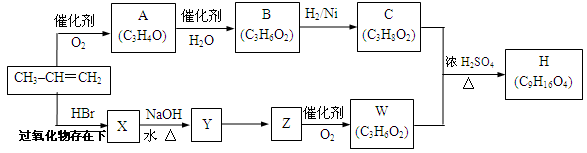
其中A、B、C、X、Y、Z、W、H均为链状化合物,A、Z均能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2(标准状况)。请回答下列问题:
(1)A中所含官能团的名称为,B的结构简式为。
(2)填反应类型:A→B,C+W→H。
(3)写出X→Y反应的化学方程式为:
。
(4)写出A与银氨溶液反应的化学方程式为:
。
(5)写出C+W→H的化学方程式为:
。
(6)符合下列条件分子式为C4H10O2的同分异构体有种,并写出其中核磁共振氢谱有3个吸收峰且吸收峰面积比为2∶2∶1的结构简式。
①与C互为同系物,②若分子中有两个羟基不能连在同一个碳原子上。
(14分)空气吹出法工艺,是目前“海水提溴”的最主要方法之一。其工艺流程如下:
(1)溴在周期表中位于第_周期第_族。
(2)步骤①中用硫酸酸化可提高Cl2的利用率,理由是_。
(3)步骤④利用了SO2的还原性,反应的离子方程式为_。
(4)步骤⑥的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因_。
(5)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是_。
(6)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氯化”后再蒸馏,这样操作的意义是_。
(8分)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO+4H++3e-―→NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:
________________________________________________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是____________________________________________________。
书写离子方程式(8分)
(1) 铜和足量浓硝酸反应的离子方程式为
(2)二氧化锰与足量浓盐酸反应的离子方程式为:
(3)向碳酸氢钾溶液中滴入少量澄清石灰水反应的离子方程式为:
(4)向明矾溶液中加入过量的氢氧化钡溶液反应的离子方程式为
【化学——选修5:有机化学基础】
3对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下: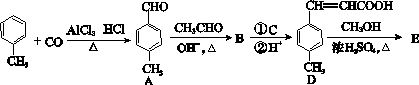
已知:HCHO+CH3CHO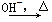 CH2===CHCHO+H2O
CH2===CHCHO+H2O
(1)遇FeCl3溶液显紫色且苯环上有两个取代基的A的同分异构体有____________种,写出其中一种的结构简式,某有机物比A多一个氧原子,它有多种同分异构体,其中属于芳香酯的有种,B中含氧官能团的名称为________。
(2)试剂C可选用下列中的________。
a.溴水 b.银氨溶液
c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(3) 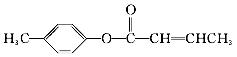 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为____________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为____________________。
(4)E在一定条件下可以生成高聚物F,F的结构简式为__________________________。