(10分) 中学常见化学反应方程式为:A+B→X+Y+H2O(未配平,反应条件略去),其中,A、B的物质的量之比为1:4。请回答:
(1)若Y为黄绿色气体,该反应的离子方程式为 ,B体现出的化学性质有 。
(2)若A为常见的非金属单质,B的溶液为某浓酸,反应条件为加热,其反应的化学方程式为 。
(3)若A为某不活泼的金属单质,该反应能产生一种造成光化学烟雾的气体,该反应中氧化剂与还原剂的物质的量之比为 。
(4)若A为常见的金属单质,常温下A在B的浓溶液中“钝化”,且A可溶于X溶液中。写出A与X的溶液反应的离子方程式 。
芳香族化合物A只有两个对位取代基,在一定条件下有如下图所示转化关系。其中,1 mol C与Na完全反应生成1 mol H2,若l mol C与NaHCO3完全反应,也产生l mol气体,E可以使溴的四氯化碳溶液褪色。
(1)D分子中的含氧官能团名称是___________,A的结构简式是___________。
(2)反应④的基本类型是_______反应,反应⑤的化学方程式是___________________________ 。
(3)与C取代基位置相同,既能与FeCl3溶液显色、又能发生水解反应的结构简式为: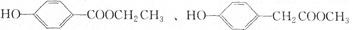 ,___________、___________。(写两种即可)
,___________、___________。(写两种即可)
(4)现有C和E的混合物n mol。在空气中完全燃烧消耗O2___________L(标准状况),若生成CO2 a L(标准状况)、H2O b g,则C、E混合物中含E的物质的量的计算式为:______________________ 。
植物精油具有抗菌消炎、解热镇痛等药物功用。从樟科植物枝叶中提取的精油中含有下列甲、乙、丙三种成分: 丙:分子式C16H14O2
丙:分子式C16H14O2
(1)甲、乙中含氧官能团的名称分别为___________ 、___________。
(2)经下列过程甲可转化为乙:
①,②的反应类型分别为___________、___________ 。
(3)通过下列合成路线由乙可得到丙(部分反应产物略去)
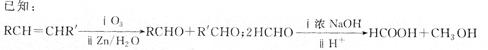
①F的结构简式为_________________________________________________________________。
②由乙制取D的化学方程式_______________________________________________________。
③写出同时符合下列要求的D的同分异构体的结构简式______________________。
a.化合物是二取代苯
b,分子中有5种不同环境的氢原子,其个数比为1:2:2:1: 2
c.能使溴的CCl4溶液褪色,且在酸性条件下可以发生水解反应
④丙的结构简式为_________________。
已知:

有机物E和F可用作塑料增塑剂或涂料的溶剂,它们的相对分子质量相等,可以用下列方法合成。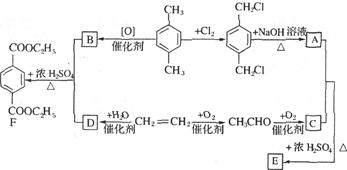
(1)写出有机物的名称: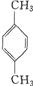 ,
,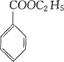 。
。
(2)写出下列反应的化学方程式。
①A+C→E。
②CH2=CH2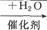 D。
D。
(3)E和F的相互关系是。
| A.同一种物质 | B.同素异形体 | C.同系物 | D.同分异构体 |
某研究性学习小组做了以下实验:向溴水中加入足量乙醛溶液,观察到溴水褪色的现象。
[提出问题]
产生上述现象的原因是什么?
[提出猜想]
①溴水与乙醛发生取代反应。
②___________________________________________________。
③___________________________________________________。
[设计方案]
方案一:检验褪色后溶液的酸碱性。
方案二:测定反应前溴水中Br2的物质的量和反应后Br-离子的物质的量。
[实验探究]
取含0.005mol Br2的溶液10mL,加入足量乙醛溶液使其褪色,再加入过量AgNO3溶液,过滤、洗涤、干燥后称重固体质量为1.88g。
[解释与结论]
假设测得反应前溴水中Br2的物质的量为a mol,
若测得反应后n(Br-)=0mol,则说明溴水与乙醛发生了____________反应。
若测得反应后n(Br-)=amol,则说明溴水与乙醛发生了____________反应。
若测得反应后n(Br-)=2amol,则说明溴水与乙醛发生了____________反应。
若已知CH3COOAg易溶解于水,试通过计算判断溴水与乙醛发生反应的类型为___________。
理由是__________________________________________________________。
其反应方程式为_______________________________________________________。
[反思与评价]
方案一是否可行?__________。理由是_______________________________________。
Fe3+可以与SCN-、CN-、F-有机分子等形成很多的配合物。
(1)写出基态Fe3+的核外电子排布式 。
(2)CN-中碳原子的杂化方式为 。
(3)已知(CN)2是直线型分子,并有对称性,则(CN)2中π键和σ键的个数比为 。
(4)写出一种与SCN-互为等电子体的分子 。(用化学式表示)
(5)下图是SCN-与Fe3+形成的一种配合物,画出该配合物中的配位键(以箭头表示)。
(6)F-不仅可与Fe3+形成[FeF6]3+,还可以与Mg2+、K+形成一种立方晶系的离子晶体(如下图)。该晶体的化学式为 。
