下表是KNO3在不同温度下的溶解度(单位:g/100g水)。
| 温度/℃ |
0 |
20 |
40 |
60 |
80 |
100 |
| 溶解度 |
13.3 |
31.6 |
63.9 |
x |
169 |
246 |
(1)表中“63.9”的含义是: 。
(2)40℃时将31克KNO3固体放入50克水中,所得溶液为 溶液(填“饱和”或“不饱和”),若降温到20℃能析出固体 克。
(3)为测定x的值,取4份60℃的水各50克,分别进行实验,并记录数据如下表:
| 实验编号 |
实验1 |
实验2 |
实验3 |
实验4 |
| KNO3质量/g |
40 |
50 |
60 |
70 |
| H2O质量/g |
50 |
50 |
50 |
50 |
| 溶液质量/g |
90 |
100 |
105 |
105 |
① 实验2所得溶液的质量分数为 。
② 上述实验中溶液质量分数相等的实验是 。
③ 由实验可知,60℃时KNO3的溶解度为 。
(4)除去KNO3固体中混有的少量NaCl,提纯的步骤是: 溶解、蒸发浓缩、 ,然后过滤、洗涤、干燥。
某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液,并用其证明与某盐酸发生了中和反应。
(1)配制100g质量分数为8%的氢氧化钠溶液。
①计算:需要氢氧化钠固体的质量为g,水的体积为mL(水的密度近似看作1g/cm3)。
②称量:调节托盘天平平衡,将一个烧杯放在托盘天平的盘,称量其质量。然后按需要添加砝码、移动游码,再将氢氧化钠固体加入烧杯中,直至天平平衡。该步骤中用烧杯而不用纸称量氢氧化钠的原因是。
③溶解:用量筒量取所需的水,倒入盛有氢氧化钠固体的烧杯里,搅拌,使其溶解,并冷却至室温。
④把配好的溶液装入试剂瓶,塞好橡皮塞并贴上标签。
(2)某兴趣小组同学为证明NaOH溶液与稀盐酸发生了中和反应,从不同角度设计了如下实验方案,并进行实验。
【实验方案】
方案一:先用pH试纸测定NaOH溶液的pH,再滴加盐酸,并不断振荡溶液,同时测定混合溶液的pH,如果测得的pH逐渐变小且最终小至小于7,则证明NaOH溶液与稀盐酸发生了化学反应。
①用pH试纸测定NaOH溶液pH时,正确的操作是:。
②简述强调“测得的pH小于7”的理由:。
方案二:化学反应中通常伴随有能量的变化,可借助反应前后的温度变化来判断反应的发生。如果NaOH溶液与稀盐酸混合前后温度有变化,则证明发生了化学反应。该组同学在没使用温度计的情况下,通过下图所示装置完成了实验。则该组同学根据
某化学实验小组的同学要配制l00g质量分数为10%的氯化钠溶液,下面是他们配制溶液的实验操作示意图,如图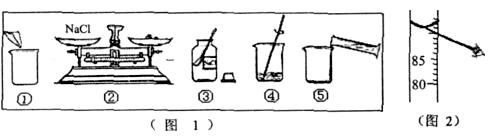
(1)该实验正确的操作顺序为。(填序号)
(2)同学们在称量氯化钠质量时,右盘未放纸片,则结果会导致所得溶液中溶质的质量分数。(填“偏大”或“偏小”或“不变”)
(3)在用托盘天平称取氯化钠的过程中,发现指针偏向分度盘的右侧,同学们接下来的操作应该是。
(4)同学们量取水的体积如图2所示,则该小组同学实际量取水的体积为mL。(取整数).所取的水的体积。(填“偏大”或“偏小”或“不变”)。若其他的操作都正确,则结果配制的溶液的质量分数。(填“偏大”或“偏小”或“不变”)。
无土栽培是一种在营养液中培育植物的农业高新技术。因为硝酸钾属于肥料,所以常用于配制营养液。小强要用5%的KNO3溶液配制150 g 溶质质量分数为2%的硝酸钾溶液,配制此硝酸钾溶液的步骤为计算、、;
现有元素H、O、Na、S等四种元素,按要求完成下列各项内容:
(1)写出由上述元素形成的双原子单质分子化学式。
(2)各元素的质量比为1:1的氧化物为,其中除氧元素外,另一种元素的化合价为。
(3)写出由上述元素组成物质发生反应的化学方程式
①有水生成的化合反应。
②有水生成的复分解反应。
化学就在我们身边,与我们的生活息息相关。请回答以下生活中的问题:
(1)家用天然气(或液化气)中常添加一种具有特殊气味的物质乙硫醇。天然气主要成分的化学式是。当闻到该气味时,提醒人注意天然气(或液化气)已经在泄露。能闻到乙硫醇的气味,这证实了分子________________的性质。
(2)通常所说的煤气中毒是指由引起的中毒。
(3)长期使用的暖水瓶内胆常有一层水垢(主要成分为CaCO3、Mg(OH)2),可以用厨房中的调料除去它。