元素周期表中某区域的一些元素多用于制造半导体材料,它们是
| A.左、下方区域的金属元素 | B.金属元素和非金属元素分界线附近的元素 |
| C.右、上方区域的非金属元素 | D.稀有气体元素 |
空气是人类生存所必需的重要资源。为改善空气质量而启动的“蓝天工程”得到了全民的支持。下列措施不利于“蓝天工程”建设的是( )
| A.推广使用燃煤脱硫技术,防止SO2污染 |
| B.实施绿化工程,防止扬尘污染 |
| C.研制开发燃料电池汽车,消除机动车尾气污染 |
| D.加大石油、煤炭的开采速度,增加化石燃料的供应量 |
某研究性学习小组,为研究光化学烟雾产生和消失规律,在一烟雾实验箱中,测得烟雾的主要成分为RH(烃)、NO、NO2、O3、PAN(CH3COOONO2),各种物质的相对浓度随时间的变化,记录于下图,根据图中数据,下列推论最不合理的是( )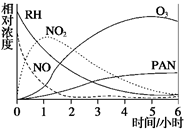
| A.NO的消失的速率比RH快 |
| B.NO转化为NO2 |
| C.O3转化为PAN |
| D.RH和NO2转化为PAN和O3 |
汽车尾气(含有烃类、CO、NOx、SO2等)是城市空气的主要污染源,治理方法之一是在汽车排气管安装“催化转化装置器”。它能使CO和NOx反应生成可参与大气生态环境循环的无毒气体,并使烃类充分燃烧、SO2转化。下列说法中正确的是( )
| A.CO和NOx反应的化学方程式为2xCO+2NOx===2xCO2+N2 |
| B.上述方法的缺点是导致空气中CO2的含量增大,从而大大提高空气的酸度 |
| C.植树造林,增大绿化面积,能从根本上控制城市的各种污染源 |
| D.汽车改用天然气或氢气作为燃料,不会减少对空气的污染 |
臭氧层的破坏导致紫外线对地球表面辐射量的增加,从而使全球皮肤癌的发病人数明显增加。造成这一现象的主要原因是( )
| A.大量使用氟氯烷烃 |
| B.在炼钢时排放大量的高炉煤气 |
| C.石油炼制厂排放了大量的甲烷、氢气 |
| D.硝酸、硫酸工厂排放了大量的二氧化硫和一氧化氮 |
你认为减少酸雨产生的途径可采取的措施( )
①少用煤作燃料 ②把工厂的烟囱造高 ③燃料脱硫
④在已酸化的土壤中加石灰 ⑤开发新能源
| A.①②③ | B.②③④⑤ | C.①③⑤ | D.①③④⑤ |