如图为以惰性电极进行电解的串联电解装置图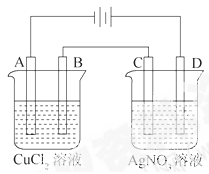
(1)写出A、B、C、D各电极上的电极方程式。
A ;
B ;
C ’
D 。
(2)在A、B、C、D各电极上析出生成物的物质的量比为 。
(1)肼(N2H4)是火箭发动机的燃料,它与N2O4反应时,N2O4为氧化剂,生成氮气和水蒸气。
已知:N2(g)+2O2(g)===N2O4(g) ΔH=+8.7 kJ/mol,N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH=-534.0 kJ/mol, 则表示肼跟N2O4反应的热化学方程式
(2)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一。
已知:CO(g)+2H2(g)  CH3OH(g)ΔH=-90.7 kJ·mol-1
CH3OH(g)ΔH=-90.7 kJ·mol-1
2CH3OH(g)  CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
CH3OCH3(g)+H2O(g)ΔH=-23.5 kJ·mol-1
CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为
______________________________________________________________________。
A和B反应生成C,假定反应由A、B开始,它们的起始浓度均为1 mol•L-1。反应进行2min
后A的浓度为0.8 mol•L-1,B的浓度为0.6 mol•L-1,C的浓度为0.6 mol•L-1。则2min内反应的平
均速率υ(A)=____________, υ(B)=_________________,υ(C)=_______________。该反应的化学
反应方程式为:_____________________________。
依据事实,写出下列反应的热化学方程式
① 2molH2与2molI2蒸汽完全反应时,生成碘化氢气体,放出了29.8KJ的热量
______________________________________________________________
② 1克甲烷完全燃烧生成二氧化碳和液态水放出了aKJ的热,写出甲烷燃烧热的热化学方程式:
_____________________________________________________________
③ 12g镁在氧气中完全燃烧,生成氧化镁固体,放出247KJ的热量
①CaCO3 ="=" CaO + CO2;ΔH= +177.7kJ/mol
②C(s) + H2O(g)="=" CO(g) + H2(g);ΔH= -131.3kJ
③0.5H2SO4(l) + NaOH(l) ="=" 0.5Na2SO4(l) + H2O(l);ΔH=+57.3kJ/mol
④C(s) + O2(g) ="=" CO2(g);ΔH=-393.5kJ/mol
⑤CO(g) + 1/2 O2(g) ="=" CO2(g);ΔH=-283kJ/mol
⑥HNO3 (aq) + NaOH(aq) ="=" NaNO3(aq) + H2O(l);ΔH= -57.3kJ/mol
⑦2H2(g) + O2(g) ="=" 2H2O(l);ΔH= -517.6kJ/mol
(1)上述热化学方程式中,不正确的有()
(2)根据上述信息,写出C转化为CO的热化学方程式。
(3)上述反应中,表示燃烧热的热化学方程式有();表示中和热的热化学方程式有()。
(10分 )工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: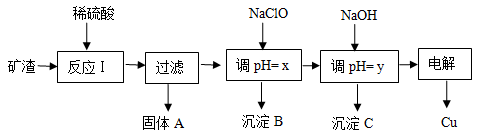
已知: Cu2O + 2H+=" Cu" + Cu2+ + H2O
| 沉淀物 |
Cu(OH)2 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
5.4 |
4.0 |
1.1 |
5.8 |
| 沉淀完全pH |
6.7 |
5.2 |
3.2 |
8.8 |
(1)反应I中如果Cu2O与Fe2O3之间恰好发生氧化还原反应,则反应的化学方程式为:___________________________________________________________________________
(2)用NaClO调pH=x是此工艺流程中的最佳选择。
①选择NaClO的理由是:____________________________________________________
②生成沉淀B的同时生成一种具有漂白作用的物质,写出该反应的离子方程式为:
_________________________________________________________________________
(3)如果某次测定pH=y的操作失误,将适量NaOH溶液滴加到0.02mol·L-1CuSO4溶液中,致使溶液中Cu2+浓度降至原来的百分之一,则溶液的pH为____。(已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20)
(4)电解初期阳极的电极反应式为________________________________