(10分 )工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下: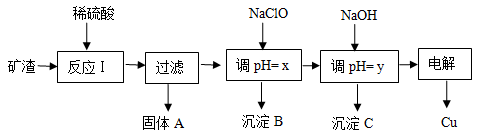
已知: Cu2O + 2H+ =" Cu" + Cu2+ + H2O
| 沉淀物 |
Cu(OH)2 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
5.4 |
4.0 |
1.1 |
5.8 |
| 沉淀完全pH |
6.7 |
5.2 |
3.2 |
8.8 |
(1)反应I中如果Cu2O与Fe2O3之间恰好发生氧化还原反应,则反应的化学方程式为:___________________________________________________________________________
(2)用NaClO调pH=x是此工艺流程中的最佳选择。
①选择NaClO的理由是:____________________________________________________
②生成沉淀B的同时生成一种具有漂白作用的物质,写出该反应的离子方程式为:
_________________________________________________________________________
(3)如果某次测定pH=y的操作失误,将适量NaOH溶液滴加到0.02mol·L-1CuSO4溶液中,致使溶液中Cu2+浓度降至原来的百分之一,则溶液的pH为 ____。(已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20)
(4)电解初期阳极的电极反应式为________________________________
(8)向20mL某物质的量浓度的AlCl3溶液中滴入2mol/L NaOH溶液时,得到的Al(OH)3沉淀的质量与所滴加的NaOH溶液的体积(mL)关系如下图所示,试回答下列问题: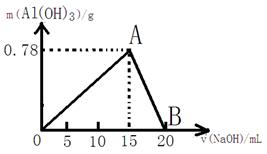
(1)上述两步反应用总的离子方程式可表示为:;
(2)若溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为。
(写出计算过程)
(7分)下图表示的反应关系中,部分产物被略去。已知2mol白色固体粉末X受热分解,恢复到室温生成白色固体A.无色液体B.无色气体C各1mol。X.E.G的焰色反应均为黄色。
回答下列问题: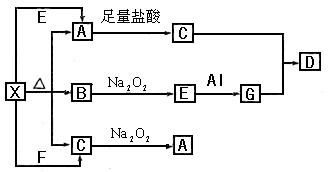
(1)写出下列物质的化学式:GD
(2)写出G与C反应生成D的化学反应方程式:
(3)写出X+E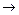 A的离子方程式:
A的离子方程式:
(4)写出C与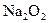 参加反应的化学方程式______________________________________,
参加反应的化学方程式______________________________________,
若0.2mol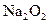 参加反应,则转移的电子数为_____________个。
参加反应,则转移的电子数为_____________个。
(5)写出物质X的用途(至少写出一种)______________________________________
某无色透明溶液,投入金属铝可放出H2。现有下列离子:Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、HCO3-、OH-。试判断下列两种情况时,各有哪些离子可存在于此溶液中:
(1)当生成Al3+时,可存在的离子有;
(2)当生成AlO2-时,可存在的离子有。
( 6分)除去下表各溶液中含有的少量杂质(括号内)填写下表:
| 物质(杂质) |
除杂质所需试剂 |
离子方程式 |
| Fe2O3(Al2O3) |
||
| FeCl2溶液(FeCl3) |
||
| NaHCO3溶液(Na2CO3) |
铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下: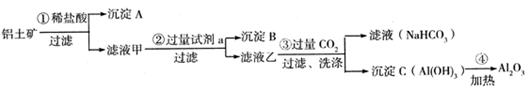
(1)沉淀 A、B的成分分别是、;
(2)步骤②中的试剂a是;
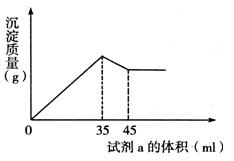
(3)试写出步骤③中发生反应的离子方式;
(4)准确称取6g铝土矿样品,加入100mL盐酸溶液,充分反应后向滤液中加入10 mol·L-1试剂a的溶液,产生沉淀的质量与加入试剂a的体积关系如下图所示,则所用盐酸溶液的物质的量浓度为,样品中Al2O3的百分含量为。