( 6分)除去下表各溶液中含有的少量杂质(括号内)填写下表:
| 物质(杂质) |
除杂质所需试剂 |
离子方程式 |
| Fe2O3(Al2O3) |
|
|
| FeCl2溶液(FeCl3) |
|
|
| NaHCO3溶液(Na2CO3) |
|
|
铅蓄电池是典型的可充型电池,它的正负极板是惰性材料,电池总反应式为:
请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时:正极的电极反应式是___________________________;电解质溶液中H2SO4的浓度将_______ (填“变大”、“变小”或“不变”);当外电路通过1 mol电子时,理论上负极板的质量增加_______ g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成____________、B电极上生成______________,此时铅蓄电池的正负极的极性将_______________________。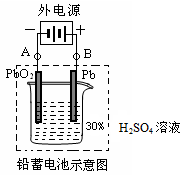
下图中每一方框中的字母代表一种反应物或生成物(部分产物未列出):
已知C是紫红色金属固体,B的浓溶液和稀溶液都是有强氧化性。
(1)A的化学式是,E化学式是;
(2)电解反应的化学(或离子)方程式是;
(3)对200ml 1mol/L的A溶液进行电解,当有0.02mol电子发生转移时,溶液的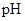 为
为
(假设溶液体积不变)。
某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化,据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是。
(2) 根据上述框图反应关系,写出下列B、D所含物质的化学式
根据上述框图反应关系,写出下列B、D所含物质的化学式
固体B;沉淀D
(3)写出①、②、两个反应的离子方程式
①
②
现有三种物质A、B、C,它们均溶于水。其中有一种是酸,一种是碱,一种是盐,溶于水后电离,可以产生下表中的离子:
| 阳离子 |
Na+H+Ba2+ |
| 阴离子 |
OH- CO SO SO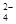 |
为鉴别它们,分别完成以下实验,其结果如下:
① A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
② B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝 酸。
酸。
请根据上述实验结果,填空:
(1)写出下列物质的化学式:X
(2)B溶于水后的电离方程式为
(3)鉴别B中阴离子的实验操作方法是
(4)B与C反应的离子方程式:
A、B、C、D、F五种物质的焰色反应均为黄色,A、B、C、D与盐酸反应均生成E,此外B还生成一种可燃气体。而C、D还生成一种无色无味气体H,该气体能使澄清石灰水变浑浊。D和A可反应生成C,F和H也可反应生成C和另一种无色无味气体。请回答下列问题:
(1)写出A、D的化学式A______ D__________
(2)写出F和H反应的化学方程式
(3)写出下列反应的离子方程式:B+水
(4)要除掉D溶液中含有的少量C,最理想的方法 是(用化学方程式表示)。
是(用化学方程式表示)。