下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
淀粉溶液中加稀硫酸,加热片刻,滴加银氨溶液,再水浴加热 |
无银镜生成 |
淀粉未发生水解 |
| B |
向溶液X中加入稀盐酸,并将产生的无色气体通入澄清石灰水中 |
生成白色沉淀 |
溶液X中一定含有CO32-或HCO3- |
| C |
将一片铝箔置于酒精灯外焰上灼烧 |
铝箔熔化但不滴落 |
铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
| D |
取久置的绿矾(FeSO4·7H2O)溶于水,加入KSCN溶液 |
溶液变为血红色 |
绿矾部分或全部被氧化 |
下列是几种原子的基态电子排布,电负性最大的原子是( )
| A.1s22s22p63s23p64s2 | B.1s22s22p63s23p3 |
| C.1s22s22p63s23p2 | D.1s22s22p4 |
下列表达式错误的是( )
A.甲烷的电子式: |
B.氮原子的L层电子排布图: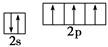 |
| C.硫离子的核外电子排布式:1s22s22p63s23p4 |
| D.碳12原子: 612C |
下列溶液中微粒的物质的量浓度关系正确的是( )
A.常温下0.1 mol/L的下列溶液① NH4Al(SO4)2、② NH4Cl、③ NH3·H2O、④ CH3COONH4溶液中,c(NH )由大到小的顺序是②>①>④>③ )由大到小的顺序是②>①>④>③ |
| B.常温下0.4 mol/L CH3COOH溶液和0.2 mol/L NaOH溶液等体积混合后溶液显酸性,则溶液中粒子浓度大小顺序为: c(CH3COOH)>c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.0.1 mol/L Na2CO3溶液与0.1 mol/L NaHCO3溶液等体积混合: c(CO  )+2c(OH-)=c(HCO )+2c(OH-)=c(HCO )+3c(H2CO3)+2c(H+) )+3c(H2CO3)+2c(H+) |
D.0.1 mol/L的氨水溶液与0.05 mol/L H2SO4溶液等体积混合后所得溶液中:c(NH )+c(NH3·H2O)=2c(SO )+c(NH3·H2O)=2c(SO ) ) |
研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2—CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。下列叙述正确的是( ) 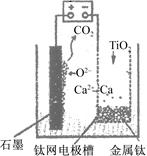
| A.该电池工作过程中O2-向阴极移动 |
| B.阳极的电极反应式为C+2O2--4e-===CO2↑ |
| C.若用铅蓄电池作该装置的供电电源,“-”接线柱应连接PbO2电极 |
| D.在制备金属钛前后,整套装置中CaO的总量减少 |
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,并于10 min时达到平衡:PCl3(g)+Cl2(g)  PCl5(g)。有关数据如下:
PCl5(g)。有关数据如下:
| PCl3(g) |
Cl2(g) |
PCl5(g) |
|
| 初始浓度/(mol/L) |
2.0 |
1.0 |
0 |
| 平衡浓度/(mol/L) |
c1 |
c2 |
0.4 |
下列判断不正确的是( )
A.10 min内,v(Cl2)=0.04 mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.升高温度,反应的平衡常数减小,则平衡时PCl3的转化率变大
D.平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件下再达平衡时, c(PCl5)<0.2 mol/L