(11分)在实验室里用乙醇跟浓H2SO4反应制取乙烯时,常因温度过高而发生副反应,部分乙醇跟浓H2SO4反应生成SO2,CO2,水蒸气和炭黑。
(1)用编号为①→④ 的实验装置设计一个实验,以验证上述反应混合气体中含CO2,SO2和水蒸气。用装置的连接顺序(按产物气流从左到右的流向):
→ → → →。
(2)实验的装置①中A瓶的现象是________;结论为______________。
B瓶中的现象是________;B瓶溶液作用为________;
是否能将B瓶溶液换成酸性高锰酸钾______ (答是,否)。
(3)装置③中加的固体药品是________装置②中盛的溶液是________。
(4)装置④生成乙烯的反应类型是______;若要验证混合气体中有乙烯,应将混合气体先通过盛____________的洗气瓶,再通过盛______的试管中。 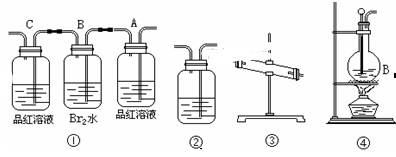
由人尿分离出来的结晶体化合物A,熔点为187—188 ℃。对化合物A做下列实验:
(1)测得A的蒸气密度为8.0 g·L-1(已折合成标准状况)。取17.92 g A完全燃烧,生成的气体通过浓H2SO4,使浓H2SO4增重8.10 g;剩余气体通过碱石灰,气体质量减轻39.60 g。另取17.92 g A完全分解,可得1.12 L(标准状况)氮气。试通过计算确定A的分子式。
(2)又知A和足量6 mol·L-1的盐酸混合加热可以完全水解,1 mol A水解生成1 mol B和1 mol C。已知A、B、C三种物质的分子中均含有一个羧基;B物质仅由碳、氢、氧三种元素组成,其物质的量之比为7∶6∶2;C俗名为甘氨酸。写出A、B、C的结构简式:
A________________________,B________________________,C______________________
有一包白色固体粉末,可能由硫酸钠、硝酸钾、硝酸铵、碳酸钙、氯化钡、硫酸铜中的一种或几种组成,做实验得以下结果:
⑴将此固体粉末加到水中,得到白色沉淀和上层无色清液;
⑵过滤后,在滤出的白色沉淀里加入稀硝酸,白色沉淀部分溶解并有无色气体生成,该气体能使澄清石灰水变浑浊;
⑶在滤液中,加入适量的氢氧化钠溶液并加热,生成有刺激性气味的无色气体,该气体能使湿润的红色石蕊试纸变蓝。
由此实验推断:该粉末中一定含有_________________________________________;
一定不含有_______________________;可能含有____________________。(填化学式)
某无色透明的溶液,跟金属铝反应时,放出H2,试判断下列离子Mg2+、Cu2+、Ba2+、H+、Ag+、SO42-、SO32-、HCO3-、OH-、NO3-在溶液中存在的情况有两种,分析后填写下表:
| 肯定存在 |
可能存在 |
肯定不存在 |
|
| 1 |
|||
| 2 |
现有四瓶未知溶液它们是:NaCl(0.1mol/L)、NaOH(0.1mol/L)、HCl(0.1mol/L)、酚酞(0.1mol/L),某化学性质小组,为了将它们鉴别出来,而又没有其他任何试剂,于是同学们采取如下的实验步骤:
(1)将四瓶溶液用A、B、C、D标记
(2)取少许溶液两两混合,根据实验现象将四种物质分成两组
(3)取甲组混合液,不断滴入乙组中的一种未知液,可以鉴别出 A:B:
(4)再取已鉴别出的溶液2ml,滴入3滴C溶液,再滴加D溶液4ml,在整个过程中无明显的实验现象;可知CD(写化学式)写出上述实验过程中反应的离子方程式
如不用任何试剂鉴别氯化钡、硝酸银、碳酸钠、盐酸四种溶液,先将四种溶液分别编为A、B、C、D进行互滴实验,将现象列表如下:
根据以上信息可以推出:A,B,C,D。