据联合国统计,2014年全球电子垃圾数量创历史新高,共达4180万吨,根据预测,到2018年,全球电子垃圾将会增长逾20%,达到5000万吨。将线路板进行处理后,可得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:

(1)第①步Cu与混酸反应的离子方程式为______________________________,得到滤渣1的主要成分为_________________,检验滤渣1是否洗涤干净的方法是 。
(2)若滤液1中含有0.5mol Fe2+,则第②步中至少加入H2O2质量为__________________,使用H2O2的优点是_________;调溶液pH的目的是____________________________________。
(3)简述第③步由滤液2得到CuSO4·5H2O的方法是______________________________________ 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,设计了以下三种方案:

上述三种方案中:_______方案不可行,原因是_______________________________;
从原子利用率角度考虑,_______方案更合理。
(5)用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2-→ CuY2-+ 2H+。写出计算CuSO4·5H2O质量分数的表达式ω=_______。
某课外小组学生对Cl2与FeBr2溶液反应进行实验探究。
(1)用浓盐酸和MnO2反应制取Cl2的化学方程式是。
(2)pH≈4的原因是(用化学用语表示)。
(3)现象i中溶液由浅绿色逐渐变黄。某学生猜测可能原因:①Cl2将Fe2+氧化为Fe3+,使溶液呈黄色;②Cl2将Br-氧化为Br2,使溶液呈黄色。证明原因①的实验方案是;证明原因②的实验方案是。
(4)现象ⅱ中,溶液变为棕黄色。部分学生猜测①:可能是Cl2先将Fe2+氧化生成Fe3+,Cl2又继续氧化Br-生成Br2。部分学生猜测②:可能是Cl2先将Fe2+氧化生成Fe3+,Fe3+将Br-氧化生成Br2。某学生设计实验进行验证,请完成下列表格:
由此实验得出的结论是 。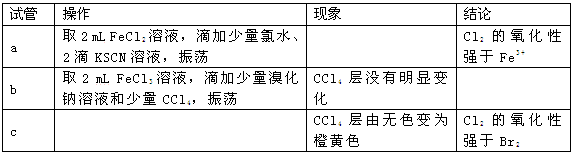
(共14分)用18mol/L的浓硫酸配制3mol/L的稀硫酸100mL,按正确的操作顺序,将序号
填入括号内并填写下列空格。
( )用少许蒸馏水洗涤小烧杯,将洗涤液沿_______注入__________并重复2次。
( )将浓硫酸沿烧杯壁慢慢注入盛有少量蒸馏水的小烧杯中,并用玻璃棒不断搅拌。
( )用量筒取浓硫酸______mL。
( )将容量瓶盖紧摇匀。
( )将已冷却的硫酸溶液沿________ 注入________ 中。
( )改用胶头滴管加蒸馏水,使溶液凹液面最低处恰好与刻度线相切。
( )继续向容量瓶内小心加蒸馏水,直至接近刻度线__________cm处。
若实验遇到下列情况,对所配溶液中硫酸的物质的量浓度有何影响(填偏高、偏低、无影响)。
(1)用量筒量取浓硫酸时俯视刻度线___________;
(2)稀释过程中不慎有硫酸液滴溅出____________;
(3)未将洗涤液加入容量瓶___________;
(4)定容时仰视刻度线__________;
(5)摇匀后发现凹液面下降,又加蒸馏水至刻度线__________;
(6)配制前容量瓶用水洗涤后未进行干燥处理__________。
实验室用NaOH固体配制250mL 1.25mol/L的NaOH溶液,填空并请回答下列问题:
(1)容量瓶上需标有以下五项中的;
①温度②浓度③容量④压强⑤刻度线
(2)配制时,其正确的操作顺序是(字母表示);
①用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
②用天平准确称取所需的NaOH的质量,加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
③将已冷却的NaOH溶液沿玻璃棒注入250mL的容量瓶中
④将容量瓶盖紧,颠倒摇匀
⑤改用胶头滴管加水,使溶液凹面恰好与刻度相切
⑥继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
配制时所需的主要实验仪器有
(4)下列操作对所配溶液浓度会造成什么影响?(填“偏高”、“偏低”或“无影响”)
①用纸称量NaOH固体。 ____________;
②向容量瓶加水定容后摇匀,发现液面低于刻度线,不采取任何措施。___;
③有少量NaOH溶液残留在烧杯内。____________;
④向容量瓶加水时眼睛一直俯视液面。____________;
⑤配制前,容量瓶中有少量蒸馏水。____________;
⑥称量NaOH时,砝码错放在左盘。____________。
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H 2C2O4 + 3H2SO4 ="==" K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
| 实验编号 |
温度/℃ |
试管中所加试剂及其用量/ mL |
溶液褪至无色所需时间/ min |
|||
| 0.6 mol/L H 2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
|||
| 1 |
20 |
3.0 |
2.0 |
3.0 |
2.0 |
4.0 |
| 2 |
20 |
3.0 |
m |
2.5 |
n |
4.8 |
| 3 |
20 |
3.0 |
3.0 |
2.0 |
2.0 |
t1 |
| 4 |
30 |
3.0 |
2.0 |
3.0 |
2.0 |
t2 |
(1)已知:实验1、2、3的目的是探究KMnO4浓度对反应速率的影响。则实验2中m=,
n=。如果研究温度对化学反应速率的影响,需利用实验4和。
(2)通过查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势如图所示。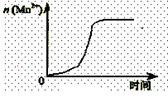
为进行实验探究,该小组同学通过讨论提出假设:Mn2+对该反应有催化作用。
①请你填写表中空白帮助该小组同学完成实验方案。
| 实验编号 |
温度/℃ |
试管中所加试剂及其用量/mL |
再向试管中加入少量固体 |
溶液褪至无色所需时间/ min |
|||
| 0.6 mol/L H 2C2O4溶液 |
H2O |
0.2 mol/L KMnO4溶液 |
3 mol/L 稀硫酸 |
||||
| 5 |
20 |
3.0 |
2.0 |
3.0 |
2.0 |
t3 |
②能说明该小组同学提出的假设成立的实验事实是。
(3)有人将酸性KMnO4溶液和H 2C2O4溶液的反应设计成原电池,则该原电池的正极反应式为。
实验室里通常用MnO2与浓盐酸反应制取氯气。现用下列有关装置先制取干燥、纯净的氯气。后进行有关性质实验。试根据下列有关装置回答有关问题。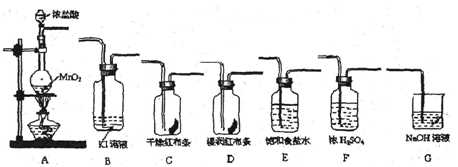
(1)上述装置中各仪器从左至右的连接顺序为A接接接接接接G。
(2)E装置的作用是,D中的现象为,
B中的现象为________________________。
(3)写出相关反应的离子方程式:A中,
G中。
(4)某温度下,将Cl2通入NaOH溶液中,反应得到含有ClO-与ClO3- 物质的量之比为1:1的混合液,反应的化学方程式是______________________________________。
(5) 报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)_______________________________________。