1,2 -二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18 g·cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验室中可以用下图所示装置制备1,2 -二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
填写下列空白:
(1)写出本题中制备1,2-二溴乙烷的两个化学反应方程式。
______________________ ; 。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象:____________________________________________。
(3)容器c中NaOH溶液的作用是:________________________________________。
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超过许多。如果装置的气密性没有问题,试分析其可能的原因。__________
______________________________________________________________________。
中和热的测定是高中重要的定量实验。取0.55mol/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从上图实验装置看,其中尚缺少的一种玻璃用品是__________,除此之外,装置中的一个明显错误是。
(2)为保证该实验成功该同学采取了许多措施,如图的碎纸条的作用在于___________。
(3)若改用60mL 0.25mol·L-1 H2SO4和50mL 0.55mol·L-1NaOH溶液进行反应与上述实验相比,所放出的热量(填“相等”、“不相等”),若实验操作均正确,则所求中和热填“相等”“不相等”)
(4)倒入NaOH溶液的正确操作是:________。 (从下列选出)。
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(5)使硫酸与NaOH溶液混合均匀的正确操作是:________。 (从下列选出)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(6)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 |
起始温度t1℃ |
终止温度t2/℃ |
温度差平均值 (t2-t1)/℃ |
||
| H2SO4 |
NaOH |
平均值 |
|||
| 1 |
26.2 |
26.0 |
26.1 |
29.5 |
|
| 2 |
27.0 |
27.4 |
27.2 |
32.3 |
|
| 3 |
25.9 |
25.9 |
25.9 |
29.2 |
|
| 4 |
26.4 |
26.2 |
26.3 |
29.8 |
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=__________ ( 取小数点后一位)。
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)________。
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
某研究性学习小组将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ、⑴按照甲同学的观点,发生反应的离子反应方程式为______________________;
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是。
Ⅱ、请用下图所示装置,选择必要的试剂,定性探究生成物的成分。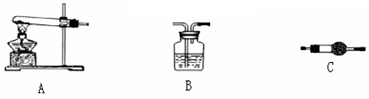
(1)各装置连接顺序为_________→_________→___________。
(2)能证明生成物中有CuCO3的实验现象是_____________________________________。
Ⅲ、若CuCO3和Cu(OH)2两者都有,可利用下列装置通过实验测定其组成。
(1)装置C中碱石灰的作用是_________________________________________。
(2)若沉淀样品的质量为m克,装置B质量增加了n克,则沉淀中CuCO3的质量分数为__________。
(13分) 用如右图装置进行铜与一定体积已知浓度的浓硫酸反应的实验研究。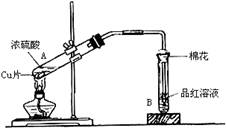
(1)写出试管B中的实验现象。
(2)写出A处反应的化学方程式,并用双线桥标明电子转移的方向和数目:。
(3)充分反应后,该学生发现铜和硫酸都有剩余。在不补充浓硫酸的前提下,若要使剩余的铜片溶解,可再加入(要求填写一种不是酸类的物质)。
(4)B试管口的棉花应沾有的试剂是,其作用是,离子方程式为。
电子工业常用30﹪的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。废腐蚀液含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,应考虑回收利用。按如下流程在实验室进行实验:从废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)写出FeCl3溶液与铜箔发生反应的化学方程式:。
(2)检验废腐蚀液中含有Fe3+的实验操作是
(3)“过滤”用到的玻璃仪器有:普通漏斗、。
(4)废液中加入过量①后,发生反应的离子方程式:
(5)上述流程中取废液200 mL,其中含CuCl2 1.5 mol·L—1、FeCl2 3.0 mol·L—1、FeCl3 1.0 mol·L—1,若要将铜全部回收,需加入Fe粉的质量应不少于_____________g;将铁的化合物全部转化为FeCl3溶液需通入Cl2的物质的量不少于_______________mol。
(6)某化学兴趣小组利用在下图装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。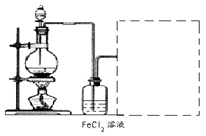
制备Cl2的化学方程式为:
该装置不完整,请在所给虚线框内画出所缺部分,并标注试剂。
某课外兴趣小组为探究某种铝合金(含Mg Al)中铝含量,设计如图装置进行实验。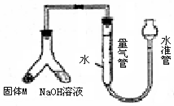
(1)如何检验该装置的气密性
(2)样品与氢氧化钠溶液反应的离子方程式:。
(3)使足量氢氧化钠溶液与ag合金(固体M)充分反应,进入量气管的气体体积为VmL
(已换算成标准状况,下同)。若a=0.036,V=22.4,该合金中铝的质量分数是。
(4)若将装置中的氢氧化钠替换为足量的盐酸,与ag合金粉末充分反应,则进入量气管内的气体体积(填“>”“<”“=”)VmL;利用此方法测得的气体体积能否进行铝的含量计算?(填“能”或“否”)