X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
I.若Z元素原子的最外层电子数是电子层数的2倍
(1)W在周期表中的位置为 。
(2)Y和Z可组成的化合物的化学式为 。
(3)写出铜和X的最高价氧化物水化物浓溶液反应的离子方程式 。
(4)W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28mol电子转移时,共产生9 mol气体,写出该反应的化学方程式_ 。
Ⅱ.若Y和Z的核外电子数之和为22
(1)工业上生产Y氢化物的适宜的反应条件是 和较高的温度;若每生成a mol乙时放出b kJ热量,则该反应的热化学方程式为 。
(2)将X的最高价氧化物通人到硅酸钠溶液中,实验现象是 。
(3)X单质与W的最高价氧化物水化物的浓溶液反应,当电子转移0.4 mol时,产生气体的体积(标准状况下)是 。
盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5 mol·L-1;H2CO3的电离常数Ka1=4.2×10-7mol·L-1、Ka2=5.6×10-11mol·L-1
(1)①请用离子方程式解释碳酸氢钠水溶液显碱性的原因。
②常温下,物质的量浓度相同的下列四种溶液:
a、碳酸钠溶液 b、醋酸钠溶液 c、氢氧化钠溶液 d、氢氧化钡溶液。
其PH由大到小的顺序是:(填序号)。
(2)某温度下,pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应的溶液中水的电离程度由大到小的顺序是;该醋酸溶液稀释过程中,下列各量一定变小的是。
a.c(H+)b.c(OH-)
c. d.
d.
(3)以0.10 mol·L-1NaOH为标准液,测定某盐酸的浓度。取20.00 mL待测盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
氢氧化钠溶液的浓度 (mol·L-1) |
滴定完成时,氢氧化钠溶液滴入的体积(mL) |
待测盐酸的体积(mL) |
| 1 |
0.10 |
24.12 |
20.00 |
| 2 |
0.10 |
23. 88 |
20.00 |
| 3 |
0.10 |
24.00 |
20.00 |
①滴定达到终点的标志是___________________________________________。
②根据上述数据,可计算出该盐酸的浓度约为__________________。
(4)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-b mol·L-1,已知a+b=12,则:
①该温度下水的离子积常数Kw= mol2·L-2。
②在该温度下,将100mL0.1 mol·L-1的稀H2SO4与100mL0.4 mol·L-1的NaOH溶液混合后,溶液的pH= 。
A、B、C、D分别为(NH4)2SO4、Ba(OH)2、AlCl3、Na2CO3 4种物质中的1种,现进行如下实验:
①实验测得A溶液和D溶液显碱性,B溶液和C溶液显酸性;
②A溶液和D溶液混合可生成沉淀甲
③足量A溶液与B溶液混合共热可生成沉淀乙和刺激性气味气体;
请回答:
(1)B的化学式为________;沉淀甲的化学式为________。
(2)足量A溶液与B溶液混合共热生成沉淀乙和刺激性气味气体的离子方程式为。
(3)加热蒸干C溶液并灼烧,最后所得固体为________(填化学式)。
(4)D溶液中各离子浓度由大到小的顺序为。
(5)已知25℃时沉淀甲的Ksp=5.1×10-9 mol2·L-2,沉淀乙的Ksp=1.1×10-10 mol2·L-2。将沉淀甲加入到B溶液中,沉淀甲会转化为沉淀乙。写出该转化反应的离子方程式:。
(10分)硫酸是工业生产中最为重要的产品之一,也是化学工业的重要原料。
(1)在硫酸工业生产中,我国采用黄铁矿为原料(与氧气反应)生产SO2,进料前必须将黄铁矿粉碎,目的是________。
(2)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是。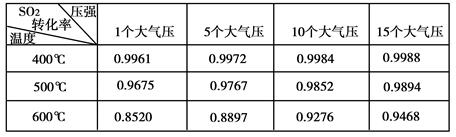
(3)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知在T2温度时:2SO2(g)+O2(g)  2SO3(g);△H=-196.6kJ·mol-1,
2SO3(g);△H=-196.6kJ·mol-1,
①在T1温度时,该反应的平衡常数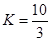 ,若在此温度下,向10L的恒容密闭容器中,充入0.3 mol SO2(g)、1.6mol O2(g) 和0.3 mol SO3(g),则反应开始时正反应速率逆反应速率(填“<”、“>”或“=”)。
,若在此温度下,向10L的恒容密闭容器中,充入0.3 mol SO2(g)、1.6mol O2(g) 和0.3 mol SO3(g),则反应开始时正反应速率逆反应速率(填“<”、“>”或“=”)。
②在T2温度时,开始在10L的密闭容器中加入4. 0 mol SO2(g)和10mol O2(g),一定条件下当反应达到平衡时共放出热量196.6kJ。此时二氧化硫的转化率为。
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原减小的是(填字母)。
| A.保持温度和容器体积不变,充入1mol O2(g) |
| B.保持温度和容器体积不变,充入2mol SO3 (g) |
| C.降低温度 |
| D.在其他条件不变时,减小容器的容积 |
研究能量的转换,最大限度的提高能量的利用率是化学研究的重要任务之一。
(1)如图为某太空站的能量转化示意图,其中燃料电池用NaOH溶液为电解液。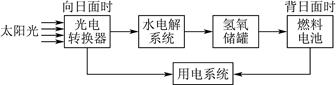
①光电转换器的能量转换形式为。
②水电解系统中通常加入少量Na2SO4,加入Na2SO4的目的是。
③燃料电池的负极反应为:。
(2)以氢氧燃料电池(电极均为石墨电极)为电,用下图装置电解稀硫酸溶液。电解初期d电极附近有大量气泡产生。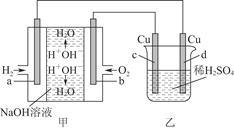
①d电极的名称是。(填“阴极”或“阳极”)
②c电极的电极反应式为:。
③通电初期乙中的总反应为:。
下图为实验室某浓盐酸试剂瓶上的标签,
试根据有关数据回答下列问题:
(1)该浓盐酸的物质的量浓度为_____mol·L—1。
(2)取用任意体积该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______。
| A.溶液中Cl-的数目 | B.溶液的密度 | C.溶质的物质的量 | D.溶液的浓度 |
(3)某学生欲用上述浓盐酸和蒸馏水配制450 mL物质的量浓度为0.4 mol/L的稀盐酸,该学生需要量取______mL上述浓盐酸进行配制(结果保留小数点后一位)。若用量筒量取浓盐酸时俯视观察凹液面,则所配制的稀盐酸物质的量浓度将(填“偏高”、“偏低”或“无影响”,下同);若定容摇匀后发现液面低于刻度线,又补加水至刻度线,则所配制的稀盐酸物质的量浓度将。
(4)取100mL 0.4 mol·L—1的盐酸与100mL 0.1 mol·L—1的AgNO3溶液混合,混合后的体积可近似为两溶液的体积之和,则所得溶液中Cl-的物质的量浓度为__ _ __。