(10分)硫酸是工业生产中最为重要的产品之一,也是化学工业的重要原料。
(1)在硫酸工业生产中,我国采用黄铁矿为原料(与氧气反应)生产SO2,进料前必须将黄铁矿粉碎,目的是________。
(2)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是 。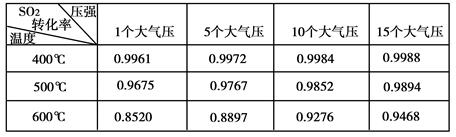
(3)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。
已知在T2温度时:2SO2(g)+O2(g)  2SO3(g);△H=-196.6kJ·mol-1,
2SO3(g);△H=-196.6kJ·mol-1,
①在T1温度时,该反应的平衡常数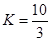 ,若在此温度下,向10L的恒容密闭容器中,充入0.3 mol SO2(g)、1.6mol O2(g) 和0.3 mol SO3(g),则反应开始时正反应速率 逆反应速率(填“<”、“>”或“=”)。
,若在此温度下,向10L的恒容密闭容器中,充入0.3 mol SO2(g)、1.6mol O2(g) 和0.3 mol SO3(g),则反应开始时正反应速率 逆反应速率(填“<”、“>”或“=”)。
②在T2温度时,开始在10L的密闭容器中加入4. 0 mol SO2(g)和10mol O2(g),一定条件下当反应达到平衡时共放出热量196.6kJ。此时二氧化硫的转化率为 。
③在②中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原减小的是 (填字母)。
| A.保持温度和容器体积不变,充入1mol O2(g) |
| B.保持温度和容器体积不变,充入2mol SO3 (g) |
| C.降低温度 |
| D.在其他条件不变时,减小容器的容积 |
(7分)从某些植物树叶中提取的有机物中含有下列主要成分:
(1)写出C的分子式________。
(2)用A、B、C、D填空:
①能 发生银镜反应的有________;②既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有___________。
发生银镜反应的有________;②既能使FeCl3溶液显紫色又能和NaHCO3反应放出气体的有___________。
(3)写出C同时满足下列条件的一种同分异构体:①含苯环且环上有两个取代基;②取代基没有环状结构;③遇FeCl3溶液发生显色反应:
(4 )写出D与乙醇反应生成酯的化学反应方程式。
)写出D与乙醇反应生成酯的化学反应方程式。
(6分)下面给出了四种烃A、B、C、D的相关信息:
①烃A在所有的烃中含碳的质量分数最低
②烃B是一种植物生长调节剂,可用于催熟果实
③烃C在氧气中燃烧产生的氧炔焰常用来切割或焊接金属
④烃D的分子比例模型如图所示:
据此回答有关问题:
(1)将A和Cl2混合充入一试管,密封后置于光亮处,一段时间后能看到试管内壁上出现的油状物不可能是(填编号)
A.CH3Cl B. CH2Cl2C. CHCl3 D CCl4
CCl4
(2)写出实验室制取B的反应类型。
(3)实验室制取C的化学方程式为。
(4) D分子中不存在碳碳单键和碳碳双键交替结构,以下能证实这一事实的是。
a.D的邻位二氯取代物不存在同分异构体
b.D的间位二氯取代物不存在同分异构体
c.D的对位二氯取代物不存在同分异构体
(5)某有机化合物X的相对分子质量大于70,小于120。经分析得知,其中碳元素和氢元素的质量分数之和为68%,其余为氧元素。则X的分子式为 。
。
(4分)写出下列各化学用语
-CH2CH3(名称),-NO2(名称),-OH(电子式),羧基(化学符号)
与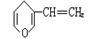 互为同分异构体的酚类化合物的同分异构体最多有
互为同分异构体的酚类化合物的同分异构体最多有
| A.3种 | B.4种 | C.5种 | D.6种 |
元素的性质在元素周期表中按其排列呈现一定的规律。下表为元素周期表中部分元素,根据要求回答下列问题:
| K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
(1)在以上元素的基态原子的电子排布中4s轨道上只有1个电子的元素有_________(填元素名称)。
(2)根据元 素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上12种元素分别属于s区、d区、ds区和p区,则属于s区的元素有________种,属于d区的元素有______种。
素原子的外围电子排布的特征,可将元素周期表分成五个区域:s区、p区、d区、ds区和f区,以上12种元素分别属于s区、d区、ds区和p区,则属于s区的元素有________种,属于d区的元素有______种。
(3)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为______;与每一个钙离子距离最近并且距离相等的钙离子有____个;CaO晶体和NaCl晶体的晶格能分别为:CaO:3 401 kJ/mol、NaC l:786 kJ/mol。导致两者晶格能差异的主要原因_______________。
l:786 kJ/mol。导致两者晶格能差异的主要原因_______________。
(4)由叠氮酸钠(NaN3)热分解可得光谱纯N2:2NaN3(s)===2Na(l)+3N2(g),下列有关说法正确的是 (选填序号)。
| A.NaN3与KN3结构类似,前者晶格能较小 |
B.金属钠的晶胞结构如图所示,每个晶胞平均分摊2个钠原子 |
| C.氮的第一电离能大于氧 |
| D.氮气常温下很稳定,是因为氮的电负性小 |