A、B、C、D分别为(NH4)2SO4、Ba(OH)2、AlCl3、Na2CO3 4种物质中的1种,现进行如下实验:
①实验测得A溶液和D溶液显碱性,B溶液和C溶液显酸性;
②A溶液和D溶液混合可生成沉淀甲
③足量A溶液与B溶液混合共热可生成沉淀乙和刺激性气味气体;
请回答:
(1)B的化学式为________;沉淀甲的化学式为________。
(2)足量A溶液与B溶液混合共热生成沉淀乙和刺激性气味气体的离子方程式为 。
(3)加热蒸干C溶液并灼烧,最后所得固体为________(填化学式)。
(4)D溶液中各离子浓度由大到小的顺序为 。
(5)已知25℃时沉淀甲的Ksp=5.1×10-9 mol2·L-2,沉淀乙的Ksp=1.1×10-10 mol2·L-2。将沉淀甲加入到B溶液中,沉淀甲会转化为沉淀乙。写出该转化反应的离子方程式: 。
(1)体积相同,c(H+)相同的盐酸和醋酸溶液分别与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率,充分反应后产生氢气的量(相同、醋酸的多、盐酸的多),原因是。
(2) 在一定量的盐酸溶液中加入足量的锌粒,要使产生氢气的量保持不变,但反应速率加快,可加入晶体,理由是;要使产生氢气的量不变,但反应速率减慢,可加入晶体,理由是。
在一定量的盐酸溶液中加入足量的锌粒,要使产生氢气的量保持不变,但反应速率加快,可加入晶体,理由是;要使产生氢气的量不变,但反应速率减慢,可加入晶体,理由是。
可供选择的晶体有:
| A.纯碱 | B.烧碱 | C.胆矾 | D.醋酸钠 E.KHSO4 |
浓度为0.1mol/L的8种溶液:①HNO3②H2SO4③HCOOH④Ba(OH)2⑤NaOH⑥CH3COONa⑦KCl⑧NH4Cl溶液pH值由小到大的顺序是(填写编号)____________。
25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L溶液。
(1)该溶液中共含有________种不同的微粒(包括分子和离子);
(2)在这些微粒中,__________和__________两种微粒的 物质的量之和等于0.01mol;
物质的量之和等于0.01mol;
(3)________和___________两种微粒的物质的量之和比H+的物质的量多0.008mol。
(1)碳酸钾的水溶液蒸干得到的固体物质是________,原因是________________。
(2)KAl(SO4)2溶液蒸干得到的固体物质是________,原因是____________________。
(3)碳酸氢钡溶液蒸干得到的固体物质是________,原因是____________________。
(4)亚硫酸钠溶液蒸干得到的固体物质是________,原因是____________________。
(5)氯化铝溶液蒸干得到的固体物质是________,原因是______________________。
将等体积的氨水与盐酸溶液混和后,若混和溶液中[NH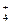 ]=[Cl-],则溶液中的pH值为______7,混和前[NH3·H2O]______[HCl],氨水中[OH-]______盐酸中[H+]。(填>、<或=,下同)
]=[Cl-],则溶液中的pH值为______7,混和前[NH3·H2O]______[HCl],氨水中[OH-]______盐酸中[H+]。(填>、<或=,下同)