将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2。完成下列化学方程式:
(1)_____KMnO4+______K2S+______KOH ===______K2MnO4+______K2SO4+______S↓+_____
(2)若生成5.44 g单质硫,反应过程中转移电子的物质的量为________;若反应中有22 mol电子转移,则生成K2SO4和S的物质的量之比为__________。
在一定条件下反应2SO2(g)+O2(g)===2SO3(g)达到平衡状态的标志是_______________________________。
①某物质含量不变②某物质转化率不变③某物质浓度不变④恒容压强不变⑤恒压体积不变⑥ v(正)= v(逆)⑦条件一定,平均相对分子质量不变⑧体积一定,气体密度不变
上述条件符合:H2(g)+ I2(g)===2HI(g)反应达平衡的有_____________;上述条件符合:A(g)+B(l)===C(g)反应达平衡的有_____________________。
密闭体系中发生下列反应:N2 + 3H2 ="===" 2NH3(正反应为放热反应),如图是某一时间段反应速率与反应进程的曲线关系图。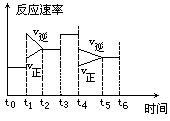
回答下列问题:
(1)处于平衡状态的时间段是_________________________________________________________
(2)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1:_______ t3:_______ t4:_________
(3)下列时间段中,氨的百分含量最高的是________
| A.t 0~t1、 | B.t2~t3 | C.t3~t4 | D.t5~t6 |
化学平衡移动原理同样也适用于其他平衡,已知在氨水中存在下列平衡:
NH3+H2O===NH3.H2O===NH4++OH-
(1)向氨水中加入MgCl2固体时,平衡向______________移动,OH-的浓度_______,
NH4+的浓度_______。
(2)向氨水中加入浓盐酸,此时溶液中浓度减小的微粒有_______、_______、_______。
(3)向浓氨水中加入少量的NaOH固体,平衡向_______移动,此时发生的现象是______________
______________。
对于溶液中进行的反应:FeCl3+3KSCN===Fe(SCN)3+3KCl,当其他条件一定时:
(1)向溶液中加入少量的KCl固体,溶液的颜色_______
(2)向溶液中加入少量KSCN固体,溶液的颜色_______
(3)加水稀释时,化学平衡向_______移动
在密闭容器中,当合成氨的反应N2+3H2===2NH3(正反应是放热反应)达到平衡时,改变如下的一些条件:
| A.升温, | B.加压, | C.减压, | D.增大c(H2),(E)减小c(NH3),(F)增大c(NH3),若平衡向右移动用“ →”,若平衡向左移动用“←”表示;若值增加用“↑”表示,若值减小用“↓”表示,请根据下表中各项的变化情况,在改变条件栏目中填上相应的编号(每项只改变一个条件)。 |
| 编号 |
改变条件 |
平衡移动方向 |
N2的转化率 |
C(NH3) |
C(N2) |
C(H2) |
| ① |
→ |
↑ |
↓ |
↓ |
↓ |
|
| ② |
← |
↓ |
↓ |
↑ |
↑ |
|
| ③ |
→ |
↑ |
↑ |
↓ |
↑ |
|
| ④ |
← |
↓ |
↓ |
↓ |
↓ |
|
| ⑤ |
→ |
↑ |
↑ |
↑ |
↑ |