在密闭容器中,当合成氨的反应N2+3H2===2NH3(正反应是放热反应)达到平衡时,改变如下的一些条件:
| A.升温, | B.加压, | C.减压, | D.增大c(H2),(E)减小c(NH3),(F)增大c(NH3),若平衡向右移动用“ →”,若平衡向左移动用“←”表示;若值增加用“↑”表示,若值减小用“↓”表示,请根据下表中各项的变化情况,在改变条件栏目中填上相应的编号(每项只改变一个条件)。 |
| 编号 |
改变条件 |
平衡移动方向 |
N2的转化率 |
C(NH3) |
C(N2) |
C(H2) |
| ① |
|
→ |
↑ |
↓ |
↓ |
↓ |
| ② |
|
← |
↓ |
↓ |
↑ |
↑ |
| ③ |
|
→ |
↑ |
↑ |
↓ |
↑ |
| ④ |
|
← |
↓ |
↓ |
↓ |
↓ |
| ⑤ |
|
→ |
↑ |
↑ |
↑ |
↑ |
实验室里通常用MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2 + 4HCl(浓) △MnCl2 + Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是mol,转移电子的物质的量是mol。
(2)报纸报道了多起卫生间清洗时,因混合使用“洁厕灵”(主要成分是盐酸)与“84消毒液”(主要成分是NaClO)发生氯气中毒的事件。试根据你的化学知识分析,原因是(用离子方程式表示)。
实验室测量KMnO4溶液浓度时常用(NH4)2Fe(SO4)2代替FeSO4作标液,(NH4)2Fe(SO4)2的制备工艺流程如下:
(1)已知流程中铁粉制备反应如下:
4 H2 O(g) +3Fe(s) Fe3O4(s)十4H2(g) △H ="a" kJ /mol
Fe3O4(s)十4H2(g) △H ="a" kJ /mol
Fe3O4(s) =" 3" Fe(s)+ 2O2(g) △H ="b" kJ/mol
则光解气态水制备H2的热化学方程式为____。
(2)步骤I中加水发生如下反应,请完善该反应:+2H2O  2H++ H2TiO3↓;
2H++ H2TiO3↓;
该步骤加入铁粉的作用是①;②。
(3)步骤Ⅳ生成(NH4)2Fe(SO4)2,其化学反应方程式为____;操作I为。
(4)已知在潮湿空气中Fe(OH)2比FeCl2更易被氧化。据此分析(NH4)2Fe(SO4)2比FeSO4稳定的原因是 。
某硫酸厂用以下几种方法处理SO2尾气。
(1)活性炭还原法
反应原理:恒温恒容.2C (s)+2SO2(g) S2(g)+2CO2(g) 。
S2(g)+2CO2(g) 。
反应进行到不同时间测得各物质的浓度如图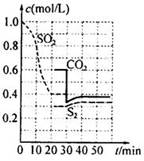
①第一次出现平衡的时间是第min;
②0~20min反应速率表示为V(SO2)=;
③30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是;40min时,平衡常数值为____。
(2)亚硫酸钠吸牧法
①Na2SO3溶液吸收SO2的离子方程式为;
②常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____(填序号)
a.c(Na+)+c(H+) >c(SO32-)+c(HSO3-)+ c(OH-)
b.c(Na+) = c(SO32-)+ c(HSO3-)+ C(H2SO3)
c.c(Na+)> c(SO32-)> c(OH一)>c(H+)
d.水电离出c(OH一)=l×l0-8 mol/L,
(3)电化学处理法
如图所示,Pt(1)电极的反应式为;碱性条件下,用P(2)电极排出的S2O42-溶液吸收NO2,使其转化为N2,同时有SO32-生成。若阳极转移电子6mol,则理论上处理NO2气体mol。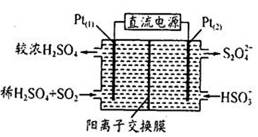
(11分)元素X、Y、Z、Q、W原子序数依次增大,其中X、Y、Z、Q为短周期元素。Z元素的焰色反应为黄色;X与Y形成的气体能使酚酞溶液变红,X与Q形成18电子的分子,其空间构型为v形,W的基态原子3d轨道有8种运动状态不同的电子。请回答下列问题:
(1)Z在周期表中的位置;W基态原于的价电子排布图。
(2)X、Y、Z、Q中,基态原子第一电离能最大的是(填元素符号)。
(3)在XQ—中Q的杂化类型为X的氧化物(X2O)晶体结构示意图如下,则1molX2O晶体含有mol氢键。
(4)ZY3有较强的还原性,遇到NaClO溶液时有无污染的气体生成,其化学方程式为
纳米级Cu2O具有特殊的光学、电学及光电化学性质,在太阳能电池、传感器、超导体等方面有着潜在的应用,研究制备纳米氧化亚铜的方法已成为当前的热点研究之一。已知Cu+易在酸性条件下发生:2Cu+=Cu2++Cu。
方法一:在新制Cu(OH)2浊液中滴入N2H4·H2O水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。
(1)写出上述制备过程中的总反应方程式。
(2)用甲醛稀溶液代替N2H4·H2O水溶液也可以实现上述转化,但需水温较高,且往往会生成极少量颗粒较大的Cu2O,用的方法可分离出颗粒过大的Cu2O。
方法二:以铜作阳极,石墨作阴极电解。已知:①铜作阳极时,铜先被氧化生成Cu+,后Cu+继续氧化生成Cu2+;②在碱性溶液中CuCl浊液易转化为Cu2O。
(3)以NaOH溶液作为电解质溶液时需添加NaCl,其目的是,写出阳极反应方程式。
(4)写出在碱性溶液中CuCl浊液转化为Cu2O的离子方程式。
(5)这样制得的Cu2O中往往含有CuCl,请设计实验证明CuCl的存在。