下列离子浓度关系正确的是 ( )
| A.0.1mol/L的NH4C1溶液中c(NH4+)=c(C1-) |
| B.同为0.1mol/L的甲酸和氢氧化钠溶液等体积混合后,溶液中c(OH-)=c(H+) |
| C.向NH4C1溶液中滴加氨水至pH=7时,c(NH4+)<c(C1-) |
| D.pH=3的H2SO4和pH=11的NaOH溶液等体积混合后,溶液中c(OH-)=c(H+) |
下列离子方程式书写正确的是
| A.用氢氧化钠溶液除去铝表面的氧化膜:Al(OH)3+OH—=AlO2—+2H2O |
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl— Mn2++Cl2↑+H2O Mn2++Cl2↑+H2O |
C.用惰性电 极电解熔融氯化钠:2Cl—+2H2O 极电解熔融氯化钠:2Cl—+2H2O Cl2↑+H2↑+2OH— Cl2↑+H2↑+2OH— |
| D.用稀氢氧化钠吸收氯气:2OH—+Cl2=Cl—+ClO—+H2O |
下列有关溶液中粒子浓度的关系式中,正确的是()
A.pH相同的①CH3COONa、②NaHCO3、③C6H5ONa三份溶液中的c(Na+):③>②>①
B.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中:c(Na+)=2c(A2-)+c(HA-)+c(H2A)
C.右图中pH=7时:c(Na+)>c(CH3COO-) >c(OH-)=c(H+)
D.右图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH)
向CuSO4溶液中逐滴加入过量KI溶液,观察到产生白色沉淀,溶液变为棕色。再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。则下列分析中正确的是()
| A.白色沉淀是CuI2,棕色溶液含有I2 |
| B.滴加KI溶液时,转移1mole-时生成2mol白色沉淀 |
| C.上述实验条件下,物质的氧化性:Cu2+>I2>SO2 |
| D.通入SO2时,SO2与I2反应,I2作还原剂 |
右图是一种可充电的锂离子电池充放 电的工作示意图。
电的工作示意图。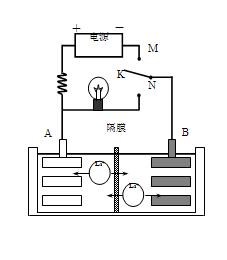
放电时该电池的电极反应式为:
负极:LixC6-xe-=C6+xLi+(LixC6表示锂原子嵌入石墨形成的复合材料)
正极:Li1-xMnO2+xLi++x e-=LiMnO2(LiMnO2表示含锂原子的二氧化锰)
下列有关说法正确的是()
A.该电池的反应式为Li1-xMnO2+LixC6 LiMnO2+C6 LiMnO2+C6 |
| B.K与M相接时,A是阳极,发生氧化反应 |
| C.K与N相接时,Li+由A极区迁移到B极区 |
| D.在整个充、放电过程中至少存在3种形式的能量转化 |
下列所述的实验方法或物质用途不正确的是()
| A.用明矾可除去中性废水及酸性废水中的悬浮颗粒 |
| B.用pH试纸检验NH3的性质时,必须先将试纸润湿 |
| C.用淀粉碘化钾试纸可鉴别NO2气体和溴蒸气 |
| D.氧化镁和氧化铝均可用作制造高温耐火材料 |