[化学 选修5-有机化学基础] (共14分)有机化合物A、B、C、D完全燃烧均只生成CO2和H2O,且四种物质含碳质量分数均为40%,含氢质量分数均约6.7% 。又知:
①A常温、常压下呈气态,A、C都能发生银镜反应,但都不能发生水解反应;
②B和C互为同分异构体,l mol B完全燃烧需耗3mol氧气。核磁共振氢谱表明,B分子有四个吸收峰,且峰面积之比为3:1:1:1,B在浓硫酸存在下加热可生成W(C6H8O4,含有一个六元环);
③ RCOOH在一定条件下可被还原为RCHO,以下是由B制取C的一种合成路线(反应条件及副产物已略去):
试回答:
(1)A含有的官能团名称为
(2)B的结构简式为 。反应B→X的化学方程式为 。
(3)C与新制的Cu(OH)2反应的化学方程式 。
(4)与B互为同分异构体,属于有机酸的酯类且含有羟基的化合物有多种,写出其中一种的结构简式: 。
(5)写出Z→C的化学反应方程式: 。
(6)若MD =" 6" MA,D是只含有一种官能团且碳原子的化学环境相同的六元环状物,又名肌醇。医学上将肌醇用于动脉硬化、高血脂症、脂肪肝的防治。则D的结构简式为 。
X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。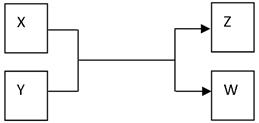
Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是。
Ⅱ.下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性。
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象。
③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84 g·cm-3,根据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗中加98%的浓H2SO4 0.5 mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释
原因。
(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO4 10 mL与铜片反应。在左边试管中所观察到与甲不同的现象除了有黑色物质出现外,还有
①,
原因是。
②,
原因是。
用Cl2消毒会使饮用水中的有机物发生氯化,生成有机氯化合物,于人体有害。世界环保联盟即将全面禁止用氯气对饮用水消毒。建议推广采用广谱性高效消毒剂ClO2气体。
(1)目前,欧洲一些国家用NaClO3氧化浓盐酸制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,该反应的化学方程式是:。
(2)我国最近研究成功用氯气氧化亚氯酸钠(NaClO2,N2保护下)制ClO2,其反应的化学方程式为:,
这一反应的优点是:。
(3)在H2SO4存在的条件下,用Na2SO3还原NaClO3也可制ClO2,其反应的化学方程式为:
。
下图表示有关物质(均是中学化学常见的物质)之间的转化关系(其
中部分参加反应的水和生成的水未列出),其中B、C为金属单质,E为非金属单质,其余均为化合物,Y、Z的组成元素相同,D为淡黄色的固体。回答系列问题: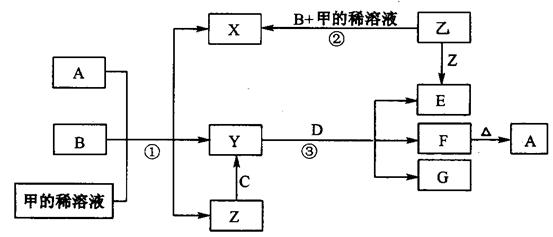
(1)B与甲稀溶液不反应,但与甲的浓溶液在加热条件下能反应。则甲为,C为(填写化学式)。
A与B物质的量应满足的关系为。
(2)写出反应③的化学方程式。
(3)反应②观察到溶液由无色变成蓝色,并且有无色气泡产生。请写出反应②发生的化学反应方程式,并分析产生气体的原因。
已知:
 |

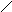

 ①+ CH3Br
①+ CH3Br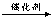 +HBr ;②C物质苯环上一卤代物只有两种。
+HBr ;②C物质苯环上一卤代物只有两种。
 |
 根据上述转化关系,回答问题:
根据上述转化关系,回答问题:
(1)写出B物质的名称;D物质的结构简式。
(2)写出反应②的类型;反应⑤的条件。
(3)写出反应⑥的化学方程式:
(4)写出E和D反应的化学方程式:
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:。
(6)分子中具有苯环,苯环上含有两个取代基,且能与NaHCO3溶液反应的E的同分异构体有_______种(不包含E)。
A、B、C、D、E均为中学化学的常见单质或化合物,它们之间的反应关系如图所示:
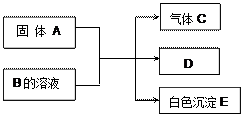 |
(1)若A是短周期中原子半径最大的元素构成的单质,E既可溶于盐酸又可溶于NaOH溶液,E溶于NaOH溶液的离子方程式是;工业上冶炼A的化学反应方程式是。
(2)若C是既含有极性键又含有非极性键的四原子分子,则实验室制取C的化学方程式是;1 mol C完全燃烧生成液态水时放热1300 kJ·mol-1,则C完全燃烧的热化学方程式是。A与B的溶液反应时只生成气体C、碳酸钙沉淀和水,则B的化学式是。