在1.0 L密闭容器中放入0.10molA(g),在一定温度进行如下反应:
A(g) 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1
容器内气体总压强(P)与起始压强P0的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)
| 时间t/ h |
0 |
1 |
2 |
4 |
8 |
16 |
20 |
25 |
 |
1.00 |
1.50 |
1.80 |
2.20 |
2.30 |
2.38 |
2.40 |
2.40 |
回答下列问题:
(1)下列能提高A的转化率的是________
A.升高温度 B.体系中通入A气体
C.将D的浓度减小 D.通入稀有气体He,使体系压强增大到原来的5倍
E.若体系中的C为HCl,其它物质均难溶于水,滴入少许水
(2)该反应的平衡常数的表达式K________________,前2小时C的反应速率是___________ mol.L-1.h-1;
(3)平衡时A的转化率_____________, C的体积分数_________(均保留两位有效数字);
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的取值范围n(D)_______mol
(5)已知乙酸是一种重要的化工原料,该反应所用的原理与工业合成乙酸的原理类似;常温下,将amol CH3COONa溶于水配成溶液,向其中滴加等体积的bmol·L-1的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数Ka=___________
烃A的分子式为C3H8,B、C是A的一氯代物,A~I有如下转化关系: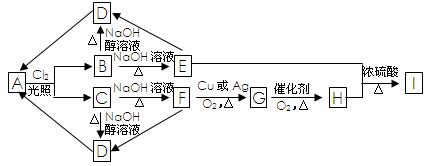
请回答下列问题:
(1)G的结构简式为。
(2)E→D的反应类型是反应。
(3)写出下列转化的化学方程式:
B→D
E+H→I
(4)H有多种同分异构体,写出满足下列两个条件的其中一种同分异构体的结构简式。
①分子结构中有烃基。②与新制的Cu(OH)2共热生成红色沉淀。
A—G都是有机物,它们的转化关系如下: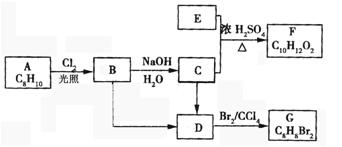
请回答下列问题:
①已知:6.0g化合物E完全燃烧生成8.8gCO2和3.6gH2O,E的蒸气与氢气的相对密度为30,则E的分子式为。
②A为一取代芳烃,B中含有一个甲基,由B生成C的化学方程式为。
③由B生成D,由C生成D的反应条件分别是,。
④由A生成B,由D生成G的反应类型分别是,。
⑤F存在于栀子香油中,其结构简式为。
⑥在G的同分异构体中,苯环上一硝化的产物只有一种的共有个,其中核磁共振氢谱有两组峰,且峰面积比为1:1的是(填结构简式)。
某有机物A,由C、H、O三种元素组成,在一定条件下,由A 可以转化为有机物B、C和D、E,C又可以转化
可以转化为有机物B、C和D、E,C又可以转化 为B、A,它们的转化关系如下:
为B、A,它们的转化关系如下:
已知D的蒸气密度是H2的22倍,并 可发生银镜反应,请回答下列问题:
可发生银镜反应,请回答下列问题:
(1)写出:A→B的反应类型是;B→C的反应类型是。
(2)反应③的反应条件是。
(3)反应④的化学方程式是。
反应⑧的化学方程式是。
(4) 写出化合物F的名称。
写出化合物F的名称。
(5)写出满足下列条件的F的同分异物体的数目,并写出其中一种的同分异特体的结构简式为。
①写F属于同类别 ②能发生银镜反应
②能发生银镜反应
Ⅰ、某烷烃的质谱图如下
①该烷烃的相对分子量为,分子式为。
②该烷烃的某种同分异构体A的核磁共振氢 谱显示只有一个峰,写出A的结构简式,用系统命名法命名为。
谱显示只有一个峰,写出A的结构简式,用系统命名法命名为。
Ⅱ、某有机物的分子式是C3H4O2,它的水溶 液呈酸性,能跟Na2CO3溶液反应,又能使溴水褪色。写出这种有机物的结构简式,写出与溴水反应的化学方程式。
液呈酸性,能跟Na2CO3溶液反应,又能使溴水褪色。写出这种有机物的结构简式,写出与溴水反应的化学方程式。
下列五组物质中___互为同位素, ___是同分异构体,___是同系物。
① 
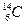 ②白磷红磷 ③
②白磷红磷 ③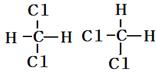
④CH3CH3 CH3CH(CH3)CH3⑤CH3CH(CH3)CH2CH3 C(CH3)4