在80 g密度为d g·cm-3的硫酸铁溶液中,含有2.8 g Fe3+,则此溶液中SO的物质的量浓度(mol·L-1)为
A. d d |
B. d d |
C.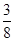 d d |
D.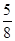 d d |
下列有关实验操作、现象和解释或结论都正确的是
| 选项 |
实验操作 |
现象 |
解释或结论 |
| A |
过量的Fe粉中加入稀HNO3,充分反应后,滴入KSCN溶液 |
溶液呈红色 |
稀HNO3将Fe氧化为Fe3+ |
| B |
用洁净铂丝蘸取溶液进行焰色反应 |
火焰呈黄色 |
原溶液中有Na+,无K+ |
| C |
Al箔插入稀HNO3中 |
无现象 |
Al箔表面被HNO3氧化,形成致密的氧化膜 |
| D |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上 |
试纸变蓝色 |
浓氨水呈碱性 |
下列实验方案中,不能测定Na2CO3和NaHCO3,混合物中Na2CO3质量分数的是
| A.取a克混合物充分加热,减重b克 |
| B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体 |
| C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克 |
| D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。 |
为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol•L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol•L-1 NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为
| A.0.005 mol | B.0.01 mol | C.0.025 mol | D.0.03 mol |
下表各选项中,不能利用置换反应通过Y得到W的一组化合物是
| 选项 化合物 |
A |
B |
C |
D |
| Y |
CO2 |
Fe2O3 |
C2H5OH |
FeCl3 |
| W |
MgO |
Al2O3 |
C2H5ONa |
CuCl2 |
.25℃、101kPa 下:①2Na(s)+1/2O2(g)=Na2O(s)△H1=-414KJ/mol
②2Na(s)+O2(g)=Na2O2(s)△H2=-511KJ/mol
下列说法正确的是
| A.①和②产物的阴阳离子个数比不相等 |
| B.①和②生成等物质的量的产物,转移电子数不同 |
| C.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D.25℃、101kPa 下,Na2O2(s)+2 Na(s)= 2Na2O(s)△H=-317kJ/mol |