下表为元素周期表的一部分,其中的序号代表对应的元素。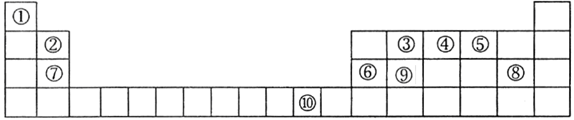
(1) 在元素③与①形成的水果催熟剂气体化合物中,元素③为______杂化;根据对角线规则,②和__________性质相似(填元素符号)。
(2)元素④的第一电离能______元素⑤(填写“>”“=”或“<”)的第一电离能;元素④与元素①形成的最简单分子X的电子式为_____ __。
(3) 将过量的X通入含有元素⑩的蓝色硫酸盐溶液中,总反应的离子方程式为_________________。
(4)⑥-AgO电池是应用广泛的鱼雷电池,其原理如下图所示。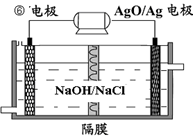
该电池的负极反应式是 。
(6) ⑧(Z)和⑨(W)比较,非金属性较弱的是 (填元素符号),下列可以验证这一结论的是 (填序号)。
| A.元素在地壳中的含量 |
| B.最高价氧化物对应水化物的酸性 |
| C.断开氢化物中1mol H―Z或H―W键所需的能量 |
| D.Z与W以共价键形成化合物时,Z或W显示的电性 |
现有下列10种物质:①铁片;②饱和食盐水;③液态硫酸;④乙醇;⑤干冰;⑥熔融硝酸钾;⑦碳酸钙固体;⑧铝条;⑨苛性钠;⑩石墨。
(1)用序号回答:能导电的是______________,属于电解质的是___________________,属于非电解质的是___________________。
(2)储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。 C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3和H2O七种。
向50mL 1mol/L的Al2(SO4)3溶液中加入50mLKOH 溶液,充分反应得到3.9g沉淀,则KOH溶液的物质的量浓度可能是或。
溶液,充分反应得到3.9g沉淀,则KOH溶液的物质的量浓度可能是或。
阅读下列两段材料,请回答下列问题:
材料一:2006年全国理综I第9题:把分别盛有熔融的氯化钾、氯化镁、氯化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为 ()
()
| A.1:2:3 | B.3:2:l | C.6:3:1 | D.6:3:2 |
材料二:已知下列表中有关物质的熔、沸点如下:
| 物质 |
K2O |
MgO |
Al2O3 |
KCl |
MgCl2 |
AlCl3 |
| 熔点(℃) |
881 |
2852 |
2015 |
711 |
714 |
190(259KPa) |
| 沸点(℃) |
-- |
3600 |
2980 |
1437 |
1412 |
181 |
(1)有人认为材料一中的题干与选项有矛盾,若选项正确,则结 合材料二可推知氯化钾、氯化镁、氯化铝三种物质中有一种物质是不符合题意的,这种物质是,其理由是
合材料二可推知氯化钾、氯化镁、氯化铝三种物质中有一种物质是不符合题意的,这种物质是,其理由是
。
(2)有人认为材料一中的题干正确,只要把一个正确的选项补加进去就是一道好题,你认为选项改加“(I)0:0:0”和“(II)6:3: 0”哪个好?(填写编号)
(3)也有人认为只要把氯化钾、氯化镁、氯化铝中的其中一种物质改为材料二表格中另一种物质也符合题意。写出电解这种物质的化学方程式:
如图是可用于测量阿伏加德罗常数的装置示意图,其中A是纯铜片、B是石墨,插在100mLCuSO4稀溶液中,铜片、石墨与引出导线相连,引出端分别为X、Y。
⑴ 当以IA的电流电解6min后,测得铜片A的质量减少了2.56g,则图装置中的X端应与直流电的极相连。
⑵ 电解后将电源反接,2IA的电流电解 6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度mol/L。溶液中H+的物质
6min后,假设溶液体积不变,测得溶液中CuSO4物质的量浓度为0.1mol/L,则原溶液中CuSO4物质的量浓度mol/L。溶液中H+的物质
的量浓度为 mol/L。
mol/L。
⑶ 列式计算实验测得的阿伏加德罗常数NA(用I表示)mol-1。(已知电子电量e=1.60×10–19C)
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2 =" 4LiCl" +S +SO2。 请回答下列问题:
请回答下列问题: (1)电池的负极材料为,该极的电极反应
(1)电池的负极材料为,该极的电极反应 式为;
式为; (2)电池正极的电极反应式为;
(2)电池正极的电极反应式为; (3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是,反应的化学方程式为;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。 如果把少量水滴到SOCl2中,实验现象是,反应的化学方程式为; (4)组装该电池必须在无水、无氧的条件下进行,原因是。
(4)组装该电池必须在无水、无氧的条件下进行,原因是。