肉桂酸是一种香料,具有很好的保香作用,通常作为配香原料,可使主香料的香气更加清香。实验室制备肉桂酸的化学方程式为: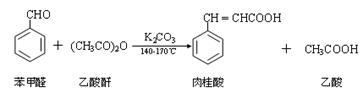
反应物和产物的部分性质如表所示:
| 名称 |
分子量 |
性状 |
密度g/cm3 |
熔点℃ |
沸点℃ |
溶解度:克/100ml溶剂 |
||
| 水 |
醇 |
醚 |
||||||
| 苯甲醛 |
106 |
无色液体 |
1.06 |
-26 |
178 |
0.3 |
互溶 |
互溶 |
| 乙酸酐 |
102 |
无色液体 |
1.082 |
-73 |
138 |
12 |
溶 |
不溶 |
| 肉桂酸 |
148 |
无色固体 |
1.248 |
133 |
300 |
0.04 |
24 |
溶 |
主要实验步骤:
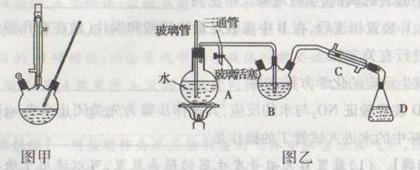
Ⅰ合成:按图甲连接仪器,加入5mL苯甲醛、14mL乙酸酐和7.0g无水碳酸钾。再加入几粒固体X,控制温度在140~170℃,将此混合物回流45min。
Ⅱ分离与提纯:
①将上述合成的产品冷却后边搅拌边加入40ml水浸泡5分钟,并用水蒸气蒸馏,从混合物中除去未反应的苯甲醛,得到粗产品
②将上述粗产品冷却后加入40ml 10%的氢氧化钠水溶液,再加90ml水,加热活性炭脱色,趁热过滤、冷却;
③将1:1的盐酸在搅拌下加入到肉桂酸盐溶液中,至溶液呈酸性,经冷却、过滤、洗涤、
干燥等操作得到较纯净的肉桂酸4.5克;
请回答下列问题:
(1)固体X的作用是防止暴沸,X的名称是
(2)图甲装置中冷凝管的作用是
(3)图乙装置中玻璃管的作用是 仪器D的名称是
(4)合成肉桂酸的实验需在无水条件下进行,实验前仪器必须干燥。实验中为控制温度在140~170℃需在 中加热(请从下列选项中选择)。
A.水 B.甘油(沸点290℃) C. 砂子 D.植物油(沸点230~325℃)
(5)本实验中,肉桂酸的产率为
下列有关实验的叙述,正确的是 (填序号,多选一个倒扣1分)
| A.分液时,分液漏斗下层液体从下口放出,上层液体从上端口倒出 |
| B.氢气还原氧化铜实验中,先加热氧化铜后通氢气 |
| C.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片 |
| D.实验室做钠的实验时,余下的钠屑投入到原试剂瓶中 |
E.浓硫酸不小心沾到皮肤上,立刻用稀NaOH溶液洗涤
F.不慎将苯酚沾到皮肤上,立即用酒精清洗;
G.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入浓硝酸中,并不断搅拌;
H.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
苯亚甲基苯乙酮俗称查尔酮,淡黄色梭状晶体,熔点58℃,沸点208℃(3.3kp),易溶于醚、氯仿和苯,微溶于醇。制备原理如下:

(1)制备过程中。需在搅拌下滴加苯甲酸,并控制滴加速度使反应温度维持在25~30℃,说明该反应是(填“放热”或“吸热”)反应。如温度过高时,则可采用措施。
(2)产品结晶前,可以加入几粒成品的查尔酮,其作用是。
(3)结晶完全后,需抽滤收集产物。’抽滤装置所包含的仪器除减压系统外还有、(填仪器名称)。
(4)获得的深色粗产品加入活性炭,用95%乙醇重结晶即得查尔酮晶体,可通过法判断原料是否反应完全以及反应的转化率和选择性。
(16分) Na2S2O3可用作照相的定影剂等。已知Na2S2O3的某些性质如下:
(1) S2O32-能被I2氧化为S4O62-;(2) 酸性条件下S2O32-迅速分解为S和SO2
Ⅰ. 市售Na2S2O3中常含有SO42-, 请完成以下方案,检验其中含有的SO42-:
| 实验步骤 |
预期现象或结论 |
| 步骤1:取少量固体样品溶于无氧蒸馏水中 |
固体完全溶解得无色澄清溶液 |
| 步骤2: |
|
| 步骤3: |
Ⅱ. 利用K2Cr2O7标准溶液可以定量测定市售硫代硫酸钠试剂的纯度,步骤为:
① 溶液配制:称取1.0gNa2S2O3试样,用新煮沸并冷却的蒸馏水溶解,最终定容至100mL。
②滴定:取10.00mL0.01mol·L-1K2Cr2O7标准溶液,加硫酸酸化,再加过量KI溶液。
③ 往步骤②所得溶液加入某指示剂,用Na2S2O3滴定至终点(2S2O32- +I2=S4O62- +2I-),记录Na2S2O3溶液用量,平行滴定3次。
(1)步骤①中必须使用的玻璃仪器有烧杯、玻璃棒、和。
(2)完成并配平步骤②中的离子反应:Cr2O72-+ ( )+I- ="=" I2 +Cr3++H2O。
(3)步骤③中,指示剂最好选用,该滴定应在接近中性的溶液中进行而不在强酸性溶液进行的原因是。
(4)若3次滴定Na2S2O3溶液的平均用量为12.00mL,则样品的纯度为。(Na2S2O3的摩尔质量为158g·mol-1)。
(16分)硅孔雀石是一种含铜矿石,含铜形态为CuCO3·Cu(OH)2和CuSiO3·2H2O,同时含有SiO2、FeCO3、Fe2O3、Al2O3等杂质。以其为原料制取硫酸铜的工艺流程如图:
(1)完成步骤①中稀硫酸与CuSiO3·2H2O反应的化学方程式:
CuSiO3·2H2O+H2SO4=CuSO4 +_______+H2O;双氧水的作用是____。
(2)步骤②调节溶液pH,可以选用的试剂是______。
| A.CuO | B.Fe2O3 | C.Al2O3 | D.Cu(OH)2 |
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
步骤②中,调节pH=4时,所得滤渣B的成分的化学式为,滤液B中除Cu2+外, 还含有的金属阳离子是。
(4)将滤液B通过、,过滤等操作可得到硫酸铜晶体。
(5)测定硫酸铜晶体结晶水的含量时,应将其放入______中灼烧。加热失水后,若在空气中冷却称量,测定结果____(填“偏高”、“偏低”或“不变”)。
下图是用于气体的制备.干燥.性质实验、尾气处理的常用装置。请根据要求回答下列问题。
(1)怎样检查装置A的气密性。
(2)某同学将仪器连接顺序为A-B-C-D,以此证明实验室制取Cl2的过程中有HCl和水蒸气挥发出来。
①A中的反应化学方程式是。
②B中盛放的试剂是,C中盛放的是CCl4溶液,其作用是,D中盛放的试剂是,实验时看到的现象是。
③有同学认为实验有缺陷,应该在C、D之间增加E装置,你认为该装置中.应放入。
(3)最后,同学们用上述除B以外的仪器组装一套可以制出纯净干燥氯气的装置,按气流方向填出接口顺序a→→ghf(不能选用B装置,其它装置可以重复使用;需要几个接口填几个).并按顺序写出所填接口对应仪器盛放的试剂。