I.某校化学学习小组为了探究草酸(H2C2O4)的化学性质,设计了如下实验:
小组成员在做草酸溶液与酸性高锰酸钾溶液反应实验时发现,溶液褪色先慢后快。
(1)上述H2C2O4溶液与酸性KMnO4溶液反应的离子方程为 。
(2)为了探究此反应速率由小变大的原因,甲同学做了如下实验(表中“一”表示未加入该试剂)。
| 实验 编号 |
反应温度 (利用水浴加热) |
稀硫酸 溶液 |
MnSO4固体 |
0.10 mol/L KMnO4溶液 |
褪色 时间 |
| 1 |
750C |
一 |
一 |
1mL |
100s |
| 2 |
750C |
10滴 |
一 |
1mL |
40s |
| 3 |
750C |
10滴 |
加入少许 |
1mL |
3s |
甲同学由此能够得出结论:
II.乙同学查资料得知“菠菜中富含可溶性草酸盐和碳酸盐”, 决定用实验验证这一事实并检测草酸盐含量。进一步查阅资料得知,草酸(H2C2O4)是酸性强于醋酸的二元弱酸,对应的钙盐(CaC2O4)不溶于醋酸,能溶于强酸。
(1) 欲准确测定菠菜中草酸盐含量,回答有关问题:
①操作:取m g菠菜样品,将其中草酸盐转化为 CaC2O4 沉淀分离出来,用盐酸溶解后,溶液转入100mL容量瓶中加水配制成100mL溶液。每次移取25.00mL该溶液,用0.0100mol·L-1 KMnO4标准溶液滴定,滴定实验重复操作2 —3次。平均消耗标准溶液V mL。
②计算:菠菜中草酸盐(以C2O42-计)的质量分数为 。(只列式不计算,已知:C2O42-的的摩尔质量为88 g•mol-1)
③讨论:用标准KMnO4溶液直接滴定菠菜研磨、浸泡、过滤得到的溶液结果可能偏高,原因是 。
MgSO4·7H2O医药上用作泻剂。工业上用氯碱工业中的一次盐泥为原料生产。已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分。主要工艺如下: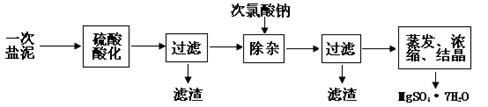
(1)用硫酸调整溶液pH到1~2,硫酸的作用是。 (2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为:。
(2)加次氯酸钠溶液至pH=5~6并加热煮沸约5~10分钟,滤渣中主要含MnO2和另两种沉淀,另两种沉淀是(写化学式)。其中次氯酸钠溶液将MnSO4转化为MnO2的离子方程式为:。
(3)若除杂后过滤,发现滤液发黄,需采取的措施是。
(4)过滤后晶体常用丙酮代替蒸馏水洗涤的目的是。
(5)晶体中结晶水含量的测定:准确称取0.20g MgSO4·7H2O样品,放入已干燥至恒重的瓷坩埚,置于马弗炉中,在200℃脱水1小时。为准确确定脱水后的质量,还需要经过的操作有:冷却(干燥器中)至室温→。
(6)硫酸根离子质量分数的测定:准确称取自制的样品0.50g,用200mL水溶液,加入2mol·L-1HCl溶液5mL,将溶液加热至沸,在不断搅拌下逐滴加入5~6mL0.5mol·L-1BaCl2溶液,充分沉淀后,得沉淀0.466g,则样品中w(SO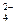 )=。
)=。
为了预防碘缺乏病,有关部门规定食盐中的碘含量(以I计)应在20~50 mg/Kg。制备KIO3的方法如下:
方法1:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;KH(IO3)2+KOH=2KIO3+H2O
方法2:碱性条件下,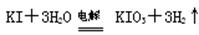
方法3: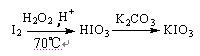
⑴与方法3相比方法1的不足是,方法2的不足是 。
⑵方法2选用的电极是惰性电极,则其阳极反应式是。
⑶方法3反应温度控制在70℃左右,不采用更高温度的主要原因是。
⑷制备纯净KIO3的实验步骤中,最后需将所得晶体最好使用洗涤2~3次,干燥后得产品。
⑸已知:KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O; I2+2S2O32-=2I-+S4O62-。为测定加碘食盐中碘的含量,设计的方案如下。请完善实验步骤并计算测定结果:
I2+2S2O32-=2I-+S4O62-。为测定加碘食盐中碘的含量,设计的方案如下。请完善实验步骤并计算测定结果:
a.准确称取w g食盐于锥形瓶中,再加适量蒸馏水使其完全溶解。
b.。
c.向锥形瓶中滴加2.0×10-3 mol/L Na2S2O3标准溶液至终点。
d.重复上述实验两次。
三次实验的数据记录如下表。则所测加碘食盐样品中的碘元素含量是mg/kg(以含w的代数式表示)。
| 滴定次数 |
盛标准Na2S2O3溶液的读数 |
|
| 滴定前刻度(/mL) |
滴定后刻度(/mL) |
|
| 1 |
1.02 |
11.03 |
| 2 |
2.00 |
11.99 |
| 3 |
0.20 |
10.20 |
实验室制乙烯时, 常因温度过高而发生副反应。部分乙醇跟浓硫酸反应生成二氧化硫.二氧化碳.水蒸气和炭黑。请用下列编号为①~⑥的实验装置设计一个实验, 以验证上述反应后的混合气中含有二氧化碳.二氧化硫和水蒸气。
(1)用装置的编号表示其连接顺序(按气体产物从左到右的流向)
(2)装置⑤中的固体药品为现象是
(3)装置①中的现象是,验证; 装置②中溴水的作用是,此时盛有澄清石灰水的装置④中出现,
某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO4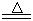 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。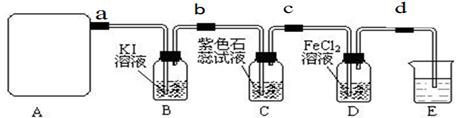
试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数)。
(2)该实验中A处可选用装置__________ _____(填写甲.乙.丙或丁)。
(3)检查A装置的气密性的方法是用弹簧夹夹住处(填a.b.c或d)橡皮管,向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静止观察,当观察到分液漏斗中时,表明该装置不漏气 .
(4) 装置B中发生反应的离子方程式为_____________________。
(5)装置C中的现象为____________________________________
(6)装置E中的试剂是______________(任填一种合适试剂的名称),
其作用是______________________________
(7)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验 步骤)
步骤)
___________________________________________________________
常温下,H2SO3的电离常数Ka1=1.2×10-2,Ka2=6.3×10-3,H2CO3的电离常数Ka1=4.4×10-7,Ka2=4.7×10-11。某同学设计实验验证H2SO3酸性强于H2CO3:将SO2和CO2气体分别通入水中至饱和,立即用酸度计测两溶液的pH 若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于。
若前者的pH小于后者,则H2SO3酸性强于H2CO3。该实验设计不正确,错误在于。
请设计合理实验验证H2SO3酸性强于H2CO3(简要说明实验步骤、现象和结论)。。仪器自选。
供选的试剂:CO2、SO2、Na2CO3、NaHCO3、Na2SO3、NaHSO3、蒸馏水、饱和石灰水、酸性KMnO4溶液、品红溶液、pH试纸。