某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO4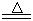 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。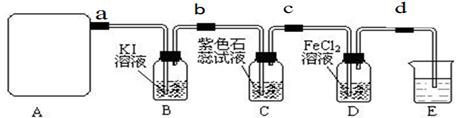
试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数)。
(2)该实验中A处可选用装置__________ _____(填写甲.乙.丙或丁)。
(3)检查A装置的气密性的方法是用弹簧夹夹住 处(填a.b.c或d)橡皮管,向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静止观察,当观察到分液漏斗中 时,表明该装置不漏气 .
(4) 装置B中发生反应的离子方程式为_____________________。
(5)装置C中的现象为____________________________________
(6)装置E中的试剂是______________(任填一种合适试剂的名称),
其作用是______________________________
(7)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验 步骤)
步骤)
___________________________________________________________
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1)①连接仪器:把玻璃导管插入橡胶塞的操作是:,然后对准橡胶塞上得空稍稍用力转动,将其插入。
②检查气体发生装置A的气密性的操作是:,向分液漏斗中注水,若水不能顺利流下,则气密性良好。
(2)整套实验装置存在一处明显不足,请指出。
用改正后的装置进行实验。实验过程如下:
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。
E装置中:CC14层先由无色变为橙色,后颜色逐渐变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因,请设计简单实验证明上述解释:。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因。
化学是一门以实验为基础的科学。
(1)下列叙述中正确的是______(填序号)。
| A.分液漏斗、滴定管和容量瓶使用前必须检查是否漏水 |
| B.将碘水倒入分液漏斗,再加适量乙醇,充分振荡、静置,可从碘水中萃取碘 |
| C.洁净的铁钉在食盐水中浸泡一段时间,铁钉上有气泡,说明铁发生了析氢腐蚀 |
| D.铁丝在氯气中剧烈燃烧,火星四射,生成黑色固体 |
E.酸碱中和滴定实验中,锥形瓶用蒸馏水洗净后直接使用,而滴定管用蒸馏水洗净后,必须润洗后使用
(2)用铜片与稀硝酸反应制取NO气体,如图装置中适合的是______(填序号);装置B中的试剂最好是______,该装置的作用是______________________。
欲测定含少量氯化钠的小苏打固态样品中NaHCO3的质量分数可采用以下四种方法。
方法四:不使用化学试剂,使用实验室常用仪器。
按要求回答下列问题:
(1)方法一是将HCO3-离子转化为沉淀并称重,则试剂A为______________(填化学式)溶液;操作2包括_______________________。
(2)方法二操作1中要用到的玻璃仪器有烧杯、玻璃棒,还需要___________________;操作2的名称是__________;该样品中NaHCO3的质量分数为_________(用含m、a的表达式表示)。
(3)根据方法三中所用的实验装置,除了称量试样质量外,还需测定的实验数据是_______________;仔细分析该实验装置,由此测得的数据计算出的实验结果有可能偏高也有可能偏低,偏高的原因可能是______________________________;偏低的原因可能是____________________________。
(4)方法四的实验原理是________________(用化学方程式表示)。
为验证氧化性Cl2>Fe3+>SO2,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为______________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是____________。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为_____________。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:
| 步骤3溶液中含有的离子 |
步骤5溶液中含有的离子 |
|
| I |
既有Fe3+又有Fe2+ |
有SO42- |
| Ⅱ |
有Fe3+无Fe2+ |
有SO42- |
| Ⅲ |
有Fe3+无Fe2+ |
有Fe2+ |
上述实验结果一定能够证明Cl2>Fe3+>SO2的是______(填“I”、“II”或“III”)。
下图5个装置都是中学化学中常见的实验装置,某学习小组的同学欲用这些装置进行常见物质的制取并探究其性质(图中a、b、c表示止水夹),请对其进行完善或评价,试回答下列问题: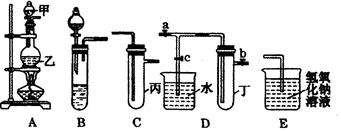
(1)将A、C、E相连后,以浓盐酸和(填写名称)为原料制取Cl2,仪器乙的名称是。
(2)利用(1)中装置和药品,在丙中加入适量水,即可制得氯水。将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
| 实验序号 |
实验操作 |
现象 |
结论 |
| Ⅰ |
将所得氯水滴入品红溶液 |
品红溶液褪色 |
氯气与水反应的产物有漂白性 |
| Ⅱ |
向所得氯水中加入碳酸氢钠粉末 |
有无色气泡产生 |
氯气与水反应至少产生一种酸性强于碳酸的物质 |
实验Ⅰ获得结论是否合理?(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):。
实验Ⅱ获得结论是否合理?(填“合理”或“不合理”)。若选“不合理”,请说明理由(若选“合理”,则无需填写理由):。
(3)利用(1)中装置还可设计一个简单的实验比较Cl-和S2-的还原性强弱。则C中预期出现的现象是。
(4)将B、D、E装置相连接(打开止水夹a和止水夹b,关闭止水夹c),在B中盛装浓硝酸和铜片(将铜片放在有孔塑料板上),可制得NO2。一段时间后,欲用D装置探究NO2与水的反应,其操作步骤为:先,再以使烧杯中的水进入试管丁,观察现象。