实验室由炼钢污泥(简称铁泥,主要成分为铁的氧化物)制备软磁性材料α﹣Fe2O3.其主要实验流程如图。

(1)酸浸。用一定浓度的H2SO4溶液浸取铁泥中的铁元素。若其他条件不变,实验中采取下列措施能提高铁元素浸出率的有 (填序号)。
A.适当升高酸浸温度
B.适当加快搅拌速度
C.适当缩短酸浸时间
(2)还原。向“酸浸”后的滤液中加入过量铁粉,使Fe3+完全转化为Fe2+.“还原”过程中除生成Fe2+外,还会生成 (填化学式);检验Fe3+是否还原完全的实验操作是 。
(3)除杂。向“还原”后的滤液中加入NH4F溶液,使Ca2+转化为CaF2沉淀除去。若溶液的pH偏低,将会导致CaF2沉淀不完全,其原因是 [Ksp(CaF2)=5.3×10﹣9,Ka(HF)=6.3×10﹣4]。
(4)沉铁。将提纯后的FeSO4溶液与氨水﹣NH4HCO3混合溶液反应。生成FeCO3沉淀。
①生成FeCO3沉淀的离子方程式为 。
②设计以FeSO4溶液、氨水﹣NH4HCO3混合溶液为原料,制备FeCO3的实验方案: [FeCO3沉淀需“洗涤完全”,Fe(OH)2开始沉淀的pH=6.5]。
(18分)一氯甲烷,也叫甲基氯,常温下是无色气体,密度为0.9159g/cm3,熔点为-97.73℃,沸点为-24.2℃,18℃时在水中的溶解度为280mL/mL水,与乙醚、丙酮或苯互溶,能溶于乙醇。在实验室里可用下图装置制造一氯甲烷: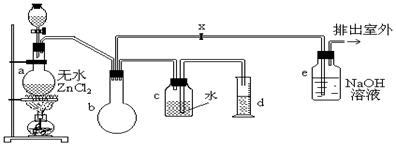
制备装置的分液漏斗和烧瓶中分别盛有甲醇和浓盐酸。
试填写下列空白:
(1)制备一氯甲烷的化学方程式,其反应类型属于反应;
(2)装置b的作用是;
(3)已知卤代烃能发生碱性水解,转化为醇。装置e中可能发生的反应方程式为;
(4)检验气体产物CH3Cl的方法是:在e的逸出口点燃CH3Cl气体,火焰呈蓝绿色(与其它烃燃烧现象有明显区别)。CH3Cl燃烧的化学方程式是;
(5)实验中实际按甲醇和浓盐酸1︰2(物质量之比)进行反应的理由是;
(6)某学生在关闭活塞x的情况下做此实验时发现,收集到一定体积的气体产物所消耗的甲醇~
浓盐酸的混和液的量比正常情况下多(装置的气密性没有问题),其原因是;
(7)实验结束后,d中收集到的液体中含有。
某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)
(1)MgCO3的分解产物为。
(2)装置C的作用是,处理尾气的方法为。
(3)将研究小组分为两组,按题26图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。(Fe2+ 遇K3[Fe(CN)6]溶液会生成蓝色沉淀)
| 步骤 |
操作 |
甲组现象 |
乙组现象 |
| 1 |
取黑色粉末加入稀盐酸 |
溶解,无气泡 |
溶解,有气泡 |
| 2 |
取步骤1中溶液,滴加K3[Fe(CN)6]溶液 |
蓝色沉淀 |
蓝色沉淀 |
| 3 |
取步骤1中溶液,滴加KSCN溶液 |
变红 |
无现象 |
| 4 |
向步骤3溶液中滴加新制氯水 |
红色褪去 |
先变红,后褪色 |
①乙组得到的黑色粉末是。
②甲组步骤1中反应的离子方程式为。
③乙组步骤4中,溶液变红的原因为;溶液褪色可能的原因及其验证方法为。
④从实验安全考虑,题图装置还可采取的改进措施是。
某研究性小组借助A-D的仪器装置完成有关实验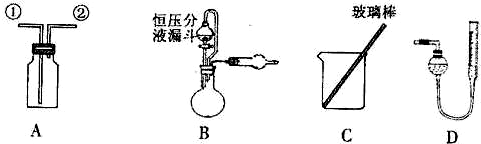
【实验一】收集NO气体.
(1)用装置A收集NO气体,正确的操作是______(填序号)。
a.从①口进气,用排水法集气 b.从①口进气,用排气法集气
c.从②口进气,用排水法集气 d..从②口进气,用排气法集气
【实验二】为了探究镀锌薄铁板上的锌的质量分数ω(Zn)和镀层厚度,查询得知锌易溶于碱:Zn+2NaOH=Na2ZnO2+H2↑据此,截取面积为S的双面镀锌薄铁板试样,剪碎、称得质量为m1g。用固体烧碱和水作试剂,拟出下列实验方案并进行相关实验。
方案甲:通过测量试样与碱反应生成的氢气体积来实现探究目标。
(2)选用B和______(填仪器标号)两个装置进行实验。
(3)测得充分反应后生成氢气的体积为VL(标准状况),ω(Zn)=______。
(4)计算镀层厚度,还需要检索的一个物理量是______。
(5)若装置B中的恒压分液漏斗改为普通分液漏斗,测量结果将______(填“偏大”、“偏小”或“无影响”)。
方案乙:通过称量试样与碱反应前后的质量实现探究目标。选用仪器C做实验,试样经充分反应,滤出不溶物、洗涤、烘干,称得其质量为m2g。
(6)ω(Zn)=______。
方案丙:通过称量试样与碱反应前后仪器、试样和试剂的总质量(其差值即为H2的质量)实现探究目标.实验同样使用仪器C。
(7)从实验误差角度分析,方案丙______方案乙(填“优于”、“劣于”或“等同于”)。
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境中会生成单质S。
Ⅰ.制备Na2S2O3·5H2O反应原理:Na2SO3(aq)+S(s)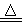 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。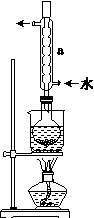
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。回答问题:
(1)仪器a的名称是________,其作用是____________________。
(2)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是__________。
检验是否存在该杂质的方法是_________________ _____。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol/L碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O42-+2I-
(3)滴定至终点时,溶液颜色的变化:________________________________。
(4)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______mL。
产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。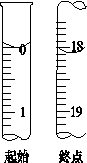
(5)如果滴定终点时俯视刻度线,所得结果 (填“偏大”“偏小”或“不变”)。
Ⅲ.Na2S2O3的应用
(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为__。
下列有关实验操作、现象和解释或结论都正确的是
| 选项 |
实验操作 |
现象 |
解释或结论 |
| A |
常温下铜片插入浓硫酸中 |
无明显现象 |
常温下铜浓硫酸钝化 |
| B |
将水蒸气通过灼热的铁粉 |
铁粉变成红棕色粉末 |
铁粉与水在高温下发生反应 |
| C |
将SO2通入滴有酚酞的NaOH溶液中 |
溶液红色褪去 |
SO2具有漂白性 |
| D |
向某溶液中先加入稀盐酸,后加入氯化钡溶液 |
先加稀盐酸无明显现象,后加氯化钡溶液有白色沉淀生成 |
溶液中存在SO42- |