Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境中会生成单质S。
Ⅰ.制备Na2S2O3·5H2O反应原理:Na2SO3(aq)+S(s)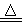 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。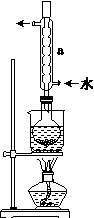
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。回答问题:
(1)仪器a的名称是________,其作用是____________________。
(2)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是__________。
检验是否存在该杂质的方法是_________________ _____。
Ⅱ.测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol/L碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O42-+2I-
(3)滴定至终点时,溶液颜色的变化:________________________________。
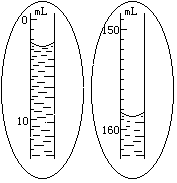
(4)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______mL。
产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。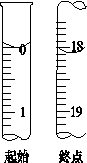
(5)如果滴定终点时俯视刻度线,所得结果 (填“偏大”“偏小”或“不变”)。
Ⅲ.Na2S2O3的应用
(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为 __。
对少量的碘化物可利用“化学放大”反应进行测定。其步骤如下:在中性或酸性介质中先用Br2将试样中的I-定量地氧化成碘酸盐,然后加入过量的KI,用CCl4萃取生成的I2(萃取率为100%)。分区水层后,用肼(即联氨H2N—NH2)的水溶液将I2反萃取至水层中(H2NNH2+2I2=4I-+N2+4H+),在用过量的Br2氧化,除去剩余的Br2后加入过量的KI,酸化,以淀粉作指示剂,用Na2S2O3标准溶液滴定(反应式为I2+2S2O32-=S4O62-+2I-),求得I-的含量。
(1)上述过程中有一些化学反应的方程式在题中未给出,请写出它们的离子方程式。
(2)根据有关反应的化学计量关系说明经上述步骤后试样中1molI-可消耗Na2S2O3的物质的量是多少?
(3)若在测定时,准确移取25.00mL含KI的试液,终点时耗用20.06mL0.100mol/L Na2S2O3溶液,请计算试液中KI的物质的量浓度。
已知理想气体各参数p(压强)、V(体积)、T(温度)、n(物质的量)满足理想气体状态方程pV=nRT。某学校课外活动小组粗略测定理想气体状态方程中气体常数R的值,下面是测定实验的分析报告,请填写有关空白:
(一)测定原理:在理想气体状态方程pV=nRT中,气体常数R=pV/nT的数值可以通过实验来确定。本实验通过金属镁置换出盐酸中的氢来测定R的值。其反应为:
Mg+2HCl=MgCl2+H2↑
如果称取一定质量的镁与过量的盐酸反应,则在一定温度和压力下,可以通过测出反应放出氢气的体积。实验室的温度和压力可以分别由温度计和气压计测得。氢气物质的量可以通过反应中镁的质量来求得。将以上所得各项数据代入R=" pV" /nT式中,即可算出R值。
(二)实验用品及试剂:①仪器:托盘天平、测定气体常数的装置(如上图所示);②试剂:6mol·L-1HCl、镁条若干。
(三)实验内容:
1.在托盘天平上称出镁条的质量(称量镁条天平的游码示数如右图所示,未用砝码,单位为g);
2.按上图搭好仪器。取下试管,移动量气管B,使量气管A中的水面略低于零刻度线,然后将量气管B固定。
3.在试管中加入15mL 6 mol·L-1HCl,不要使盐酸沾湿试管的上半部。将已称重的镁沾少许水,贴在试管上部不与盐酸接触。
4.检查仪器是否漏气,方法如下:(方法要求简单有效)
。
5.如果装置不漏气,调整量气管B的位置,使量气管A内水面与量气管B 内水面在同一水平面上(要求“在同一水平面上”的原因是;实现“在同一水平面上”的操作是),然后准确读出量气管A内水面凹面最低点的读数V1(如右图所示)。
6.轻轻摇动试管,使镁条落入盐酸中,镁条与盐酸反应放出氢气。此时量气管A内水面即开始下降。为了不使量气管A内气压增大而造成漏气,在量气管A内水面下降的同时,慢慢(上或下)移量气管B,使两管内的水面基本保持水平。反应停止后,待试管冷却至室温(约10分钟),移动量气管B,使两管内的水面相平,读出反应后量气管A内的精确读数V2(如右图所示)。
7.记录实验时的室温t和大气压P。(已知室温为27℃,大气压为100kPa)
(四)数据记录与处理(在横线上填写适当内容):
| 镁条的质量 |
w= |
g |
|
| 氢气的物质的量 |
n= |
mol |
|
| 反应前量气管A内读数 |
V1= |
ml |
|
| 反应后量气管A内读数 |
V2= |
ml |
|
| 氢气的体积 |
V |
ml |
|
| 室温 |
T |
K |
|
| 大气压 |
P |
Pa |
气体常数R的值(计算过程和结果):
(五)问题与讨论:①在读取量气管内气体体积V1时,眼睛仰视读数,结果造成R的测定值(偏高、偏低或无影响);②若没等反应试管冷却到室温就量取液面的高度,结果造成R的测定值(偏高、偏低或无影响)。
用下列仪器、药品验证由铜和适量浓硝酸反应产生的气体中含NO(仪器从图示所列中选用,N2和O2的用量可自由控制)。已知:①NO+NO2+2OH-→2NO+H2O②气体液化温度:NO2 21℃,NO-152℃
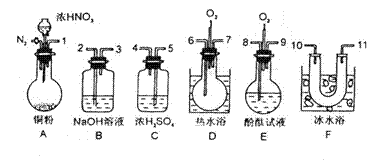 |
试回答:
(1)仪器的连接顺序(按左→右连接,填各接口的编号)为。
(2)反应前应通入N2,目的是。
(3)装置F的作用是。
(4)确认气体中含NO的现象是。
(5)若通入O2过量则B中反应的化学方程式为。
在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”,请分别用下图中示意的两套仪器装置,制取上速铁的氧化物和“引火铁”,实验中必须使用普通铁粉、6molL-1盐酸,其它试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。
填写下列空白:
(1)实验进行时试管A中应加入的试剂是
烧瓶B的作用是;
烧瓶C的作用是
在试管D中收集得到的是
(2)实验时,U型管G中应加入的试剂是
分液漏斗H中应加入
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应字母)
(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是
(5)试管E中发生反应的化学方程式是
(6)为了安全,在E管中的反应发生前,在F出口处必须;E管中反应开始后,在F出口处应
“卤块”的主要成分为MgCl2(含Fe2+、Fe3+、Mn2+等杂质离子),若以它为原料,按如下工艺流程图,即可制得“轻质氧化镁”。如果要求产品尽量不含杂质离子,而且成本较低,流程中所用试剂或PH值控制可参考下列附表确定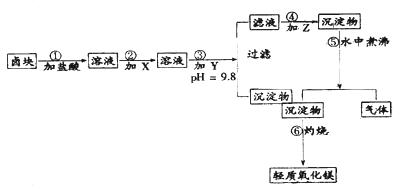
轻质氧化镁生产工艺流程图
表1生成氢氧化物沉淀的PH值
| 物质 |
开始沉淀 |
沉淀完全 |
| Fe(OH)3 Fe(OH)2 Mn(OH)2 Mg(OH)2 |
2.7 7.6 8.3 9.6 |
3.7 9.6 9.8 11.1 |
*)注:Fe2+氢氧化物呈絮状,不易从溶液中除去,所以常常将它氧化成为Fe3+,生成
Fe(OH)3沉淀而去除之。
表2化学试剂价值表
| 试剂 |
价格(元/t) |
| 漂液(含NaClO25.2%) H2O2(30%) NaOH(固98%) Na2CO3(固99.5%) 卤块(MgCl2,30%) |
450 2400 2100 600 310 |
请填写以下空白:
(1)在步骤②加入的试剂X,最佳选择应是,其作用是。
(2)步骤③加入的试剂Y应是;之所以要控制pH=9.8,其目的是。
(3)在步骤⑤时发生的化学反应方程式是: