单晶硅是信息产业中重要的基础材料。工业上可用焦炭与二氧化硅的混合物在高温下与氯气反应生成SiCl4和CO,SiCl4经提纯后用氢气还原得高纯硅。以下是实验室制备SiCl4的装置示意图。
实验过程中,石英砂中的铁、铝等杂质也能转化为相应氯化物,SiCl4、AlCl3、FeCl3遇水均易水解 ,有关物质的物理常数见下表:
,有关物质的物理常数见下表:
| 物质 |
SiCl4 |
AlCl3 |
FeCl3 |
| 沸点/℃ |
57.7 |
- |
315 |
| 熔点/℃ |
-70.0 |
- |
- |
| 升华温度/℃ |
- |
180 |
300 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式:_____________, 装置D的硬质玻璃管中发生反应的化学方程式是 。 (2)装置C中的试剂是 ; D、E间导管短且粗的原因是 。
(2)装置C中的试剂是 ; D、E间导管短且粗的原因是 。 (3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
(3)G中吸收尾气一段时间后,吸收液中肯定存在OH-、Cl-和SO42-。请设计实验,探究该吸收液中可能存在的其他酸根离子(忽略空气中CO2的影响)。
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-;假设3: 。
【设计方案,进行实验】可供选择的实验试剂有:3 mol/L H2SO4、1 mol/L NaOH、0.01 mol/L KMnO4、溴水、淀粉-KI、品红等溶液。
取少量吸收液于试管中,滴加3 mol/L H2SO4至溶液呈酸性,然后将所得溶液分置于a、b、c三支试管中,分别进行下列实验。请完成下表:
| 序号 |
操 作 |
可能出现的现象 |
结论 |
| ① |
向a试管中滴加几滴 溶液 |
若溶液褪色 |
则假设1成立 |
| 若溶液不褪色 |
则假设2或3成立 |
||
| ② |
向b试管中滴加几滴 溶液 |
若溶液褪色 |
则假设1或3成立 |
| 若溶液不褪色 |
假设2成立 |
||
| ③ |
向c试管中滴加几滴 溶液 |
|
假设3成立 |
Ⅰ.甲同学利用下列装置验证木炭与浓硫酸反应的全部产物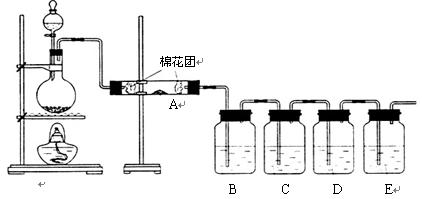
(1)写出木炭与浓硫酸反应的化学方程式:
(2)A中加入的试剂是,B、D中加入的试剂都是品红溶液,D中正确的实验现象是:
(3)实验时,C中若加入的是滴有淀粉的碘水,观察到的现象是,
离子方程式为:。
Ⅱ.乙同学只用B、C、D、E装置验证SO2的某些性质,请回答下列问题:
(1)C中加入的试剂是,证明SO2具有氧化性。
(2)D中加入酸性的KMnO4溶液,证明SO2具有性。
(3)E中加入滴有酚酞的NaOH溶液,证明SO2是性气体。
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯。在实验室我们可以用如图所示的装置来制取乙酸乙酯。回答下列问题:
(1)写出试管a中发生的化学方程式:
。
(2)试管b中所盛的溶液为 ,其主要作用是。
,其主要作用是。
(3)试管b中的导管要在液面的稍上方,不能插入液面以下,其目的是。
(4)该实验中,若用3mol乙醇和1mol乙酸在浓硫酸作用下加热,充分反应后,能否生成1mol乙酸乙酯?(填“能”或“不能”)原因是
 。(不考虑原料损耗)。
。(不考虑原料损耗)。
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组 分的质量分数。
分的质量分数。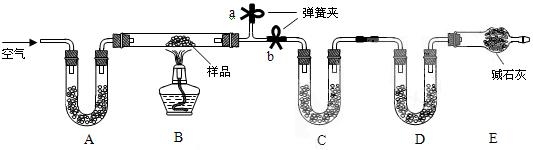
⑴加热前通入空气的目的是 _____________________________________________,操作方 法为______________________________________________。
法为______________________________________________。
⑵装置A、C、D中盛放的试剂分别为A___________,C__________,D__________。
⑶若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将(填“偏高”、“偏低”或“无影响”,下同);若B中反应管右侧有水蒸气冷凝,则测定结果中测定结果中NaHCO3的含量将___________;若撤去E装置,则测得Na2CO3·10H2O的含量__________。
⑷若样品质量为 w g,反应后C、D增加的质量分别为 m1 g、m2 g,由此可知混合物中NaHCO3质量分数为_____________________(用含w、m1、m2的代数式表示)
实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸和浓硝酸的混合酸,加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50℃~60℃发生反应,直至反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏,得到 纯硝基苯。
纯硝基苯。
填写下列空白:
(1)配制一定比例浓H2SO4和浓HNO3混合酸时,操作注意事项是
。
(2)步骤③中,为了使反应在50℃~60℃下进行,常用的方法是。
(3)步骤④中洗涤、分离粗硝基苯使用的仪器是。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是。
(5)纯硝基苯是无色,密度比水(填“小”或“大”),具有气味的油状液体。
(6)实验室制备硝基苯化学方程式。
某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式:_____
________________________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是反应。
(2)甲和乙两个水浴作用不相同。甲的作用是;乙的作用是。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是。集气瓶中收集到的气体的主要成分是。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有。要除去该物质,可先在混合液中加入(填写字母)。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过(填试验操作名称)即可除去。