如图为电解装置,X、Y为电极材料,a为电解质溶液。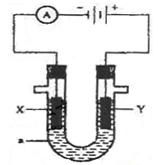
(1)若a为含有酚酞的KCl溶液,X为Fe,Y为石墨,电解一段时间后:
X电极附近可观察到的实验现象是 ;
写出Y电极的电极反应式 。
(2)若要实现Cu +H2SO4=CuSO4+H2↑,
则Y电极材料是 ;
写出X电极的电极反应式 。
(3)若要利用该装置在铁制品表面镀上一层银,则a为 ,反应前两电极的质量相等,反应后电极质量相差2.16g,则该过程理论上通过电流表的电子数为 。
(4)若X、Y均为惰性电极,a为NaOH溶液,电解一段时间后,溶液的pH (填“增大”“不变”“减小”),若要使溶液恢复原来的状态,可往溶液中加入 。
[化学与技术]
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有MgO、Al2O3、Fe2O3等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图: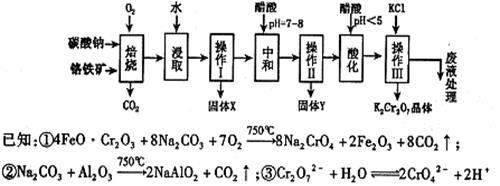
根据题意回答下列问题:
(1)固体X中主要含有 (填写化学式);要检测酸化操作中溶液的pH是否等于4.5,应该使用 (填写仪器或试剂名称)。
(2)酸化步骤用醋酸调节溶液pH<5,其目的是 。
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KCl固体、蒸发浓缩、
、过滤、 、干燥。
(4)下表是相关物质的溶解度数据。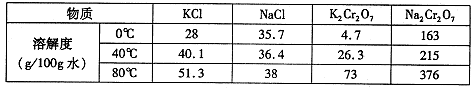
操作III发生反应的化学方程式是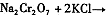
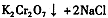 。该反应在溶液中能发生的理由是 。
。该反应在溶液中能发生的理由是 。
(5)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取ng样品,加入过量 (填写试剂)、溶解、过滤、再加入过量 (填写试剂)、……灼烧、冷却、称量,得干燥固体mg。计算祥品中氢氧化铝的质量分数为 (用含m、n的代数式表示)。
[物质结构与性质]
(1)根据价层电子对互斥理论判断下列分子或离子中空间构型是V形的是 (填写序号)
a.H3O+ b.H2O c.NO2+ d.NO2﹣
(2)已知FeCl3的沸点:319℃,熔点:306℃,则FeCl3的晶体类型为 .P可形成H3PO4、HPO3、H3PO3等多种酸,则这三种酸的酸性由强到弱的顺序为 (用化学式填写)
(3)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2.T的基态原子外围电子(价电子)排布式为 Q2+的未成对电子数是 .
(4)如图1是从NaCl或CsCl晶体结构图中分割出来的部分结构图,判断NaCl晶体结构的图象是图1中的 .
(5)[Cu(NH3)4]2+配离子中存在的化学键类型有 (填序号).
①配位键②金属键③极性共价键④非极性共价键⑤离子键⑥氢键,若[Cu(NH3)4]2+具有对称的空间构型,且当[Cu(NH3)4]2+中的两个NH3被两个Cl﹣取代时,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 (填序号)
①平面正方形②正四面体③三角锥形④V形。
(6)X与Y可形成离子化合物,其晶胞结构如图2所示.其中X和Y的相对原子质量分别为a和b,晶体密度为ρg/cm3,则晶胞中距离最近的X、Y之间的核间距离是
cm(NA表示阿伏伽德罗常数,用含ρ、a、b、NA的代数式表达)
下图I中表示在2L的密闭容器中、T1温度下,某可逆反应各物质浓度与时间关系;图II表示当其它条件不变时,C物质的体积分数(C%)与温度(T)和压强(p)的关系。回答下列问题:
(1)该可逆反应的化学方程式为 。
(2)上述反应的压强p1 p2,反应的焓变△H 0(填“大于”、“小于”或“等于”)
(3)若温度T1时,5min后反应达到平衡,则
①平衡时体系总的物质的量为 。
②反应的平衡常数K= 。(列式计算)
③反应在0~5min区间的平均反应速率v(B)= 。
X、Y、Z、M和N均为短周期元素,X、Y、Z原子序数依次增大且最外层电子数之和为15,X与Z可形成XZ、XZ2型分子, Y与M气态化合物标准状况下密度约0.76g/L。N的原子半径为短周期元素中最大。回答下列问题:
(1)M、Z和N的元素符号分别为 、 、 。
(2)X、Y、Z、M四种元素的原子半径由大到小的顺序为 。
(3)由上述元素组成、既含有共价键又含有离子键的化合物,其中含有极性共价键或含有非极性共价键,各举一例用电子式表示为 、 。
(4)X和Y组成的离子XY-对环境有害,可在NaClO的碱性溶液中转化为碳酸盐和氮气,相应的离子方程式为 。
元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
(1).三氟化溴(BrF3)常用于核燃料生产和后处理,遇水立即发生如下反应:3BrF3 +5H2O → HBrO3 + Br2 + 9HF+ O2 。该反应中氧化剂与还原剂的物质的量之比为 ,每生成2.24 LO2(标准状况)转移电子数为 。
(2).在食盐中添加少量碘酸钾可预防缺碘。为了检验食盐中的碘酸钾,可加入醋酸和淀粉-碘化钾溶液。看到的现象是 ,相应的离子方程式是 。
氯常用作饮用水的杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)  Cl2(aq)---------------①
Cl2(aq)---------------①
Cl2(aq)+ H2O  HClO + H+ +Cl------②
HClO + H+ +Cl------②
HClO  H+ + ClO- ---------------③
H+ + ClO- ---------------③
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如下图所示。
(3).写出上述体系中属于电离平衡的平衡常数表达式:Ki = ,由图可知该常数值为 。
(4).在该体系中c(HClO) + c(ClO-) c(H+)-c(OH-)(填“大于”“小于”或“等于”)。
(5).用氯处理饮用水时,夏季的杀菌效果比冬季 (填“好”或“差”),请用勒夏特列原理解释 。