向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )
A.a点发生反应的离子方程式是:  Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓ |
| B.b点消耗Ba(OH)2溶液体积为200mL |
| C.从a→b 、b→c点过程中发生反应的离子方程式依次为: NH4++OH-=NH3·H2O Al(OH)3+OH-=AlO2-+2H2O |
| D.沉淀的质量:a点>c点 |
某同学设计了测定镀锌铁皮锌镀层的厚度的实验方案:将单侧面积为S、质量为m1的镀锌铁皮放入6mol/LHCl溶液中,当气泡产生速率显著减小时,取出铁片,用水冲洗,烘干称量,称得的质量为m2。下列说法不正确的是
| A.当铁片产生气泡速率减慢时,立即取出铁片,不冲洗就用酒精灯加热烘干,铁片可能继续与残留的酸反应,导致实验结果偏高 |
| B.试验中产生气泡的速率是先慢,然后逐渐加快,再显著减慢,这是微电池和温度共同影响的结果 |
| C.锌和铁在酸溶液中形成原电池,外电路中电流从铁流向锌。 |
| D.设锌镀层为h,锌的密度为ρ,则h = (m1— m2)/2ρS |
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考下图,从下表中选出正确选项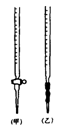
| 锥形瓶中的溶液 |
滴定管中的溶液 |
选用指示剂 |
选用滴定管 |
|
| A |
碱 |
酸 |
石蕊 |
(乙) |
| B |
酸 |
碱 |
酚酞 |
(甲) |
| C |
碱 |
酸 |
甲基橙 |
(甲) |
| D |
酸 |
碱 |
石蕊 |
(乙) |
根据下列有关图象,说法正确的是
| A.由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0 |
| B.由图Ⅱ知,反应在t6时,NH3体积分数最大 |
| C.由图Ⅱ知,t3时采取降低反应温度的措施 |
| D.图Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量 |
用下列实验装置进行的实验,能达到相应实验目的的是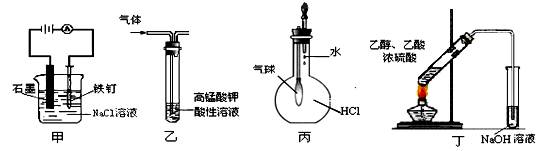
A.装置甲:防止铁钉生绣 B.装置乙:除去乙烯中混有的乙炔
C.装置丙:验证HCl气体在水中的溶解性 D装置丁:实验室制取乙酸乙酯
在盛有氯化钴溶液的试管中,加入一定量的浓盐酸,溶液的颜色的变化是
| A.蓝色加深 | B.红色加深 | C.由粉红色变为蓝色 | D.由蓝色变为粉红色 |