工业上通常用黄铁矿(主要成分FeS2)为原料生产硫酸,先将黄铁矿粉碎,然后按照以下流程制备硫酸: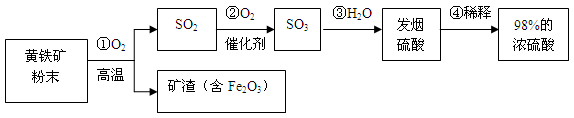
⑴ 先将黄铁矿石粉碎的目的是 。
⑵ 写出稀释浓硫酸的具体操作步骤 。
⑶ 将10g98%的浓硫酸稀释成9.8%的稀硫酸,需要加水 g。
⑷ 取20g矿渣样品(含Fe2O3),向其中加入300g溶质质量分数为9.8%的稀硫酸(已知矿渣中的Fe2O3与稀硫酸恰好完全反应得到Fe2(SO4)3溶液),试通过化学方程式计算该矿渣样品中Fe2O3的质量分数。
以下是某研究小组探究影响反应速率部分因素的相关实验数据.
| 实验序号 |
过氧化氢溶液浓度、% |
过氧化氢溶液体积/ml |
温度/C |
二氧化锰的用量/g |
收集氧气的体积/ml |
反应所需的时间/s |
| ① |
5 |
1 |
20 |
0.1 |
4 |
15.05 |
| ② |
15 |
1 |
20 |
0.1 |
4 |
3.03 |
| ③ |
30 |
5 |
35 |
2 |
48.21 |
|
| ④ |
30 |
5 |
55 |
2 |
10.95 |
(1)通过实验①和②对比可知,化学反应快慢与有关;
(2)通过对比实验③和可知,化学反应快慢与温度的关系是。
(3)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是
实验室常用加热氯酸钾与二氧化锰混合物的方法制取氧气,写出反应的文字表达式: _____________________
小倩发现,氯酸钾与氧化铁混合加热,也能较快产生氧气,于是进行如下探究:
【提出猜想】除二氧化锰、氧化铁外,氧化铜也可以作氯酸钾分解的催化剂.
【完成实验】按下表进行实验:测定分解温度(分解温度越低,催化效果越好).
| 实验编号 |
实验药品 |
分解温度(℃) |
| ① |
氯酸钾 |
580 |
| ② |
氯酸钾、二氧化锰(质量比1:1) |
350 |
| ③ |
氯酸钾、氧化铁(质量比l:1) |
390 |
| ④ |
氯酸钾、氧化铜(质量比1:1) |
370 |
【分析数据、得出结论】
(1)由实验与实验④对比,证明猜想合理;
(2)实验所用的三种金属氧化物,催化效果最好的是________.
【反思】
(1)若要证明氧化铜是该反应的催化剂,还要验证它在化学反应前后质量和____不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证___________________________________________________;
一瓶久置的氢氧化钠固体已经发生了变质,某研究小组为了探究氢氧化钠的变质纯度,作出如下猜想:猜想一、可能部分变质,固体是NaOH和Na2CO3的混合物;猜想二、可能全部变质,固体是Na2CO3。
(1)首先对固体的成分进行确定。取少量固体于试管中,加水充分溶解,先加入足量的BaCl2溶液,产生白色沉淀,静置后取上层溶液,再加入CuSO4溶液,产生蓝色絮状沉淀。根据实验现象,可判断是正确的。
(2)称取10.6克该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如下表:
| 样品质量 |
反应前总质量 |
反应后总质量 |
| 10.6克 |
148.5克 |
146.3克 |
计算该样品中Na2CO3的质量分数。
(3)请你分析,一定质量的NaOH固体,变质前后与足量的稀盐酸反应,变质前生成NaCl
的量(填“大于”、“等于”、或“小于”)变质后生成NaCl的量。
某同学为了测定黄铜屑(由锌和铜形成的合金)样品组成,取四份样品分别加稀硫酸反应,其实验数据记录如下表。
| 样品 |
第1份 |
第2份 |
第3份 |
第4份 |
| 取样品质量(g) |
50.0 |
50.0 |
50.0 |
50.0 |
| 取稀硫酸质量(g) |
40.0 |
80.0 |
120.0 |
160.0 |
| 产生气体质量(g) |
0.4 |
0.8 |
1.0 |
1.0 |
试计算:
⑴根据测得的数据分析,第1份样品中(填物质)完全反应了。
⑵列式计算黄铜屑样品中的锌的质量分数。
⑶请在图中画出在50.0g样品中加稀硫酸的质量与产生气体质量变化关系的示意图。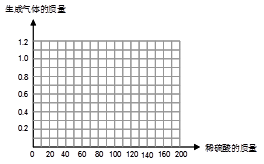
浓硫酸是化学实验室的一种常用试剂,小王同学在实验室里观察到一瓶浓硫酸的标签,如下图
| 浓硫酸(500ml) 相对分子质量 98 溶质质量分数 98% 密度 1.84克/毫升 |
(1)小王在取用时不小心把浓硫酸滴在纸上,发现纸很快变黑炭化,这是发生了变化。
(2)实验室经常需要把浓硫酸稀释成稀硫酸来使用,若浓硫酸和水的体积按1:4的比例稀释,所得稀硫酸的溶质质量分数是多少?
(3)实验后,小王没有把浓硫酸的瓶盖拧紧,久置后这瓶浓硫酸的溶质质量分数会变小,这是因为浓硫酸具有。