在硫酸铝、硫酸钾和明矾[KAl(SO4)2·12H2O]的混合溶液中,SO42—的浓度为0.4mol/L,当加入等体积0.4mol/L KOH溶液时,生成的沉淀恰好完全溶解。则反应后溶液中K+的浓度约为
| A.0.225mol/L | B.0.25mol/L | C.0.45mol/L | D.0.9mol/L |
中科院化学所合成了一种茚双加成C60衍生物ICBA(见图),以其为受体与聚(3-己基噻吩) (P3HT)共混制备的聚合物太阳能电池能量转换效率达到5.44%。有关该技术的下列说法正确的是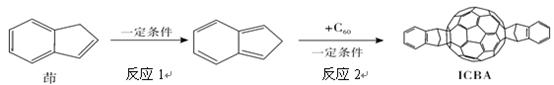
| A.合成ICBA用到的原料茚不能使酸性KMnO4溶液褪色 |
| B.C60是碳元素的一种同位素 |
| C.反应2属于加成反应 |
| D.ICBA与C60互为同素异形体 |
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是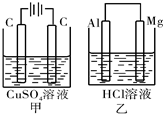
| A.溶液的质量变化:甲减小乙增大 |
| B.溶液pH值变化:甲减小乙增大 |
| C.相同条件下产生气体的体积:V甲 = V乙 |
| D.电极反应式:甲中阴极:Cu2++2e- |
下列实验的基本操作正确的是
| A.为提高高锰酸钾溶液的氧化能力,用盐酸将高锰酸钾溶液进行酸化 |
| B.在使用试纸测定某溶液的pH时,必须先用蒸馏水湿润,再将待测液滴到试纸上 |
| C.向某未知溶液中先加入过量稀盐酸,再加入BaCl2溶液,检验是否含SO42- |
| D.将一定量的水加入到10 mL 18 mol/L的浓硫酸中使溶液总体积变为100 mL,则稀释后的溶液的浓度为1.8 mol/L |
用NA代表阿伏加德罗常数,下列说法正确的是
| A.标准状况下,11.2LSO3所含的分子数为0.5 NA |
| B.1 mol Cl2参加氧化还原反应,转移的电子数目一定是2 NA |
| C.在熔融状态下,l mol NaHSO4完全电离出的阳离子数目为2 NA |
| D.46 g二氧化氮和四氧化二氮混合气体中含有的原子数为3 NA |
T℃时,A气体与B气体反应生成C气体. 反应过程中A、B、C浓度变化如图(Ⅰ)所示,并于t1时刻达到平 衡;若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图(Ⅱ)所示. 则下列结论正确的是()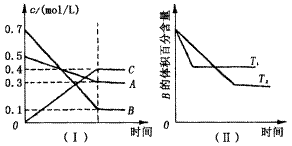
A. 在(t1+10)min时,保持其它条件不变,增大压强,平衡逆向移动
B. 其它条件不变,升高温度,A的转化率一定增大
C. T℃时,若由0.4mol/L A、0.4mol/L B和0.2mol/L C反应,达到平衡后,c(C)仍为0.4mol/L
D. (t1+10) min时,保持压强不变,通入稀有气体,平衡向正反应方向移动